1.1 Rekapitulation Schulwissen
In den Schulbüchern der gymnasialen Oberstufe wird die Grignard-Reaktion nicht behandelt. Aber bevor ich das jetzt in Stein meißle, schaue ich vorsichtshalber noch einmal in die aktuellen Oberstufenbücher hinein.
Schroedel Chemie heute Qualifikationsphase (2014): kein Eintrag im Register gefunden.
Klett Elemente Chemie Oberstufe (2015): kein Eintrag im Register gefunden.
Pearson Chemie für die gymnasiale Oberstufe (2013): kein Eintrag im umfangreichen Register gefunden.
Auch in den Richtlinien bzw. dem Kernlehrplan Chemie NRW findet sich nicht über diesen wichtigen Reaktionstyp.
Ein ehemaliger Schüler von mir hat einen sehr schönen Gastbeitrag zum Thema Grignard-Reaktion geschrieben, den ich Ihnen nicht vorenthalten möchte. Der Autor hat das Thema sehr anschaulich und schülergerecht dargestellt.
1.2 Studienvorbereitung
Victor Grignard hat die nach ihm benannten Grignard-Verbindungen während seiner Doktorarbeit um 1899 entdeckt. 1912 erhielt er dafür den Nobelpreis für Chemie. Unter einer Grignard-Reaktion versteht man die Reaktion einer Grignard-Verbindung mit anorganischen oder organischen Reagenzien.
1.2.1 Grignard-Verbindungen
Was ist nun eine Grignard-Verbindung und wie stellt man sie im Labor her?
1.2.1.1 Was ist eine Grignard-Verbindung?
Unter einer Grignard-Verbindung versteht man im Grunde ein Halogenalkan, in das sich ein Magnesium-Atom "eingeschlichen" hat:
R-Mg-X
R ist dabei ein Alkyl- oder Arylrest, Mg das Magnesium-Atom und X ein Halogen (Cl, Br oder I). Hier ein paar Beispiele:
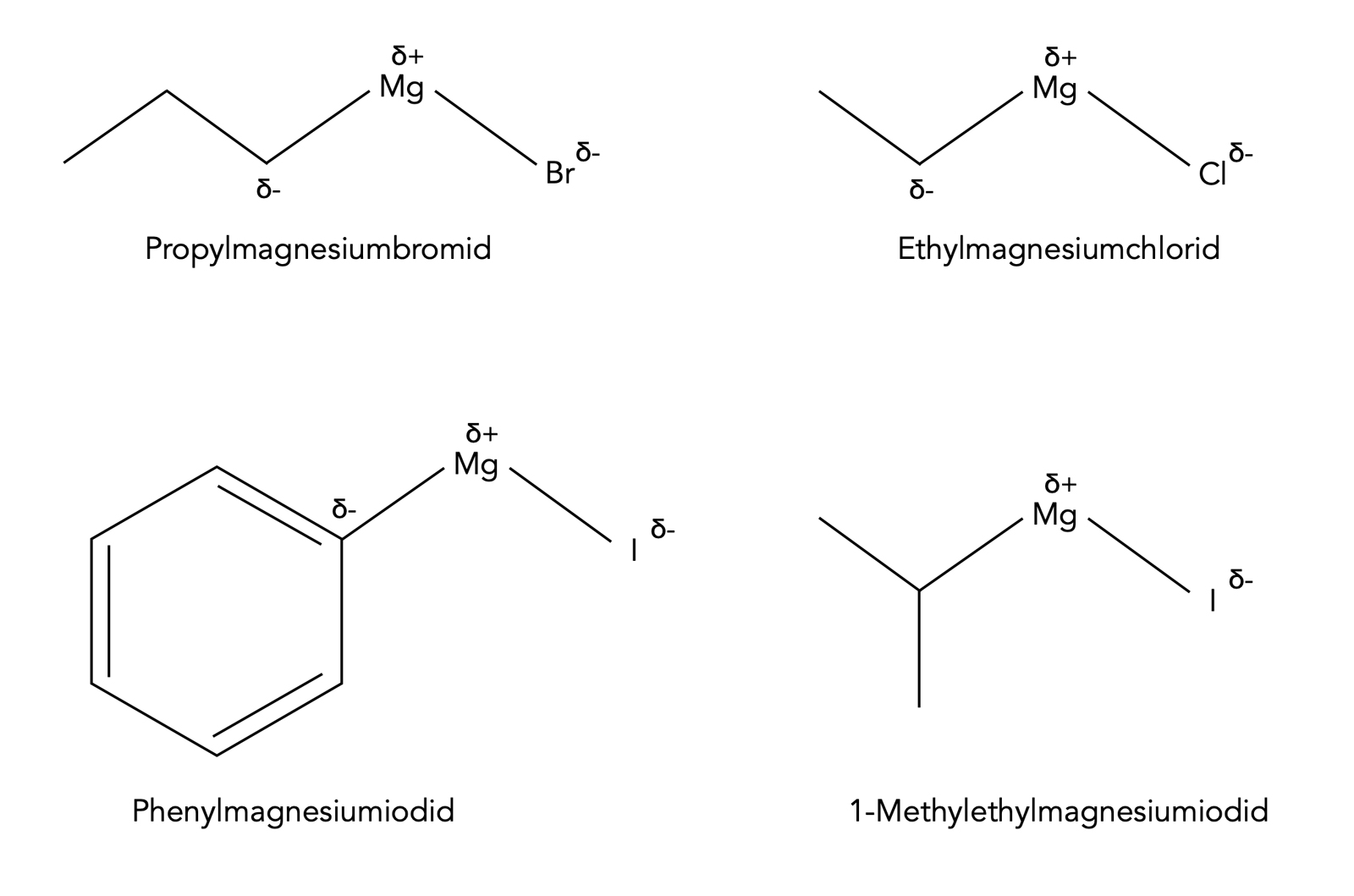
Vier Beispiele für Grignard-Verbindungen
Autor: Ulrich Helmich 07/2023, Lizenz: Public domain
Die Nomenklatur der Grignard-Verbindungen sollte aus der Abbildung hervorgehen: Erst der Alkylrest, dann das Wort "magnesium", dann das Halogen, also beispielsweise Propylmagnesiumbromid oder Ethylmagnesiumchlorid.
1.2.1.2 Wie stellt man eine Grignard-Verbindung her?
Im Prinzip ist das ganz einfach: Man besorgt sich absolut wasserfreien Ether und gibt ein paar Magnesium-Späne oder -Pulver dazu. Dann lässt man unter ständigem Rühren das Halogenalkan zutropfen. Im Kolben fängt es an zu brodeln, und es ensteht die Grignard-Verbindung.
In dem berühmten "Organikum" [6] findet sich folgende Anleitung (hier stark gekürzt):In einem Kolben mit Tropftrichter und Rückflusskühler werden 0,5 mol Magnesiumspäne mit 50 ml wasserfreiem Ether unter Rühren mit 1/20 von ingesamt 0,5 mol Alkylhalogenid versetzt.
Das Reaktionsgemisch trübt sich und wird warm.
Dann lässt man unter ständigem Rühen den Rest des in wasserfreiem Ether gelösten Alkylhalogenids zutropfen.
Das Gemisch fängt leicht an zu sieden. Wird das Sieden zu stark, kühlt man den Kolben mit Wasser. Wenn das gesamte Magnesium aufgelöst ist, ist die Reaktion beendet.
1.2.1.3 Wie ist eine Grignard-Verbindung aufgebaut?
Das ist eine gute Frage, an der noch geforscht wird. Das Magnesium-Atom scheint kovalent an den Alkylrest gebunden zu sein, und das Halogen-Atom wiederum kovalent an das Mg-Atom.
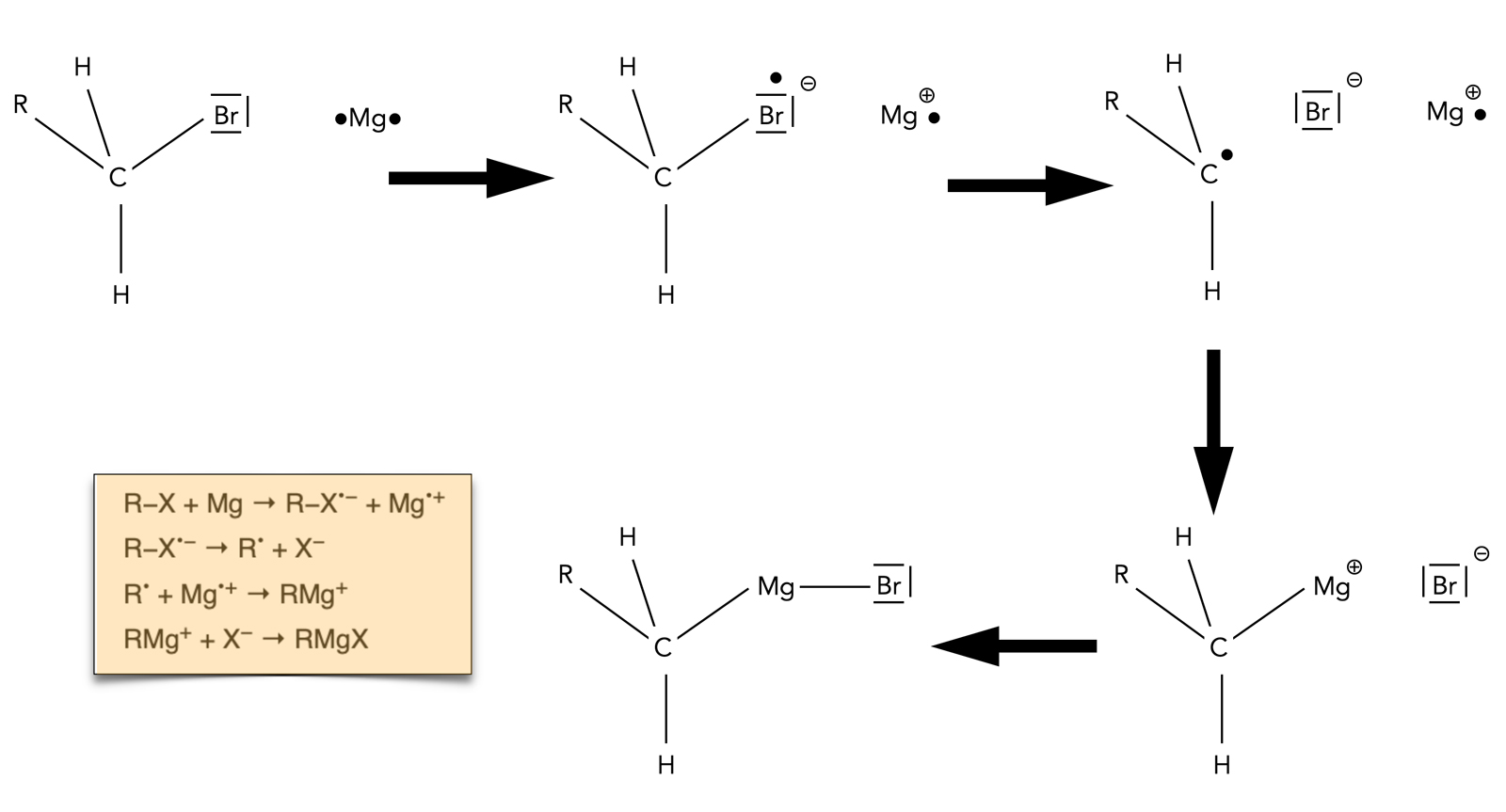
Bildung einer Grignard-Verbindung
Autor: Ulrich Helmich 07/2023, Lizenz: Public domain
Die engl. Wikipedia stellt in dem Artikel "Grignard reagent" einen interessanten, teils radikalischen Mechanismus vor, nach dem eine Grignard-Verbindung aus dem Halogenalkan und Magnesium entstehen soll. Ich habe die vier Reaktionsgleichungen (Kasten in dem Bild) in eine graphische Darstellung übertragen und hoffe, dabei keinen Fehler gemacht zu haben.
Was ich selbst noch nicht so ganz verstehe, ist der erste Schritt. Das Mg-Atom gibt also ein Elektron an das Halogenalkan ab, laut Gleichung 1 und der entsprechenden Zeichnung müsste dann das Brom-Atom neun Außenelektronen besitzen. Gut, die höheren Halogene haben neben den s- und p-Orbitalen auch noch d- und f-Orbitale, also sollte die Aufnahme eines zusätzlichen Elektrons kein Problem sein. Mit dem Schalen- oder Kugelwolkenmodell aus der Schule könnte man das jetzt nicht erklären.
Im zweiten Schritt bilden sich dann ein Alkyl-Radikal als Zwischenprodukt und ein reguläres Bromid-Ion. Das positiv geladende Magnesium-Radikal wird aus dem ersten Schritt unverändert übernommen.
Im dritten Schritt entsteht dann eine stark polare kovalente Bindung zwischen dem C-Atom des Alkylrestes und dem Mg-Atom, das Bromid-Ion bleibt zunächst unverändert.
Im vierten Schritt schließlich entsteht eine kovalente Bindung (aber mit stark ionischem Charakter) zwischen dem Mg-Atom und dem Br-Atom.
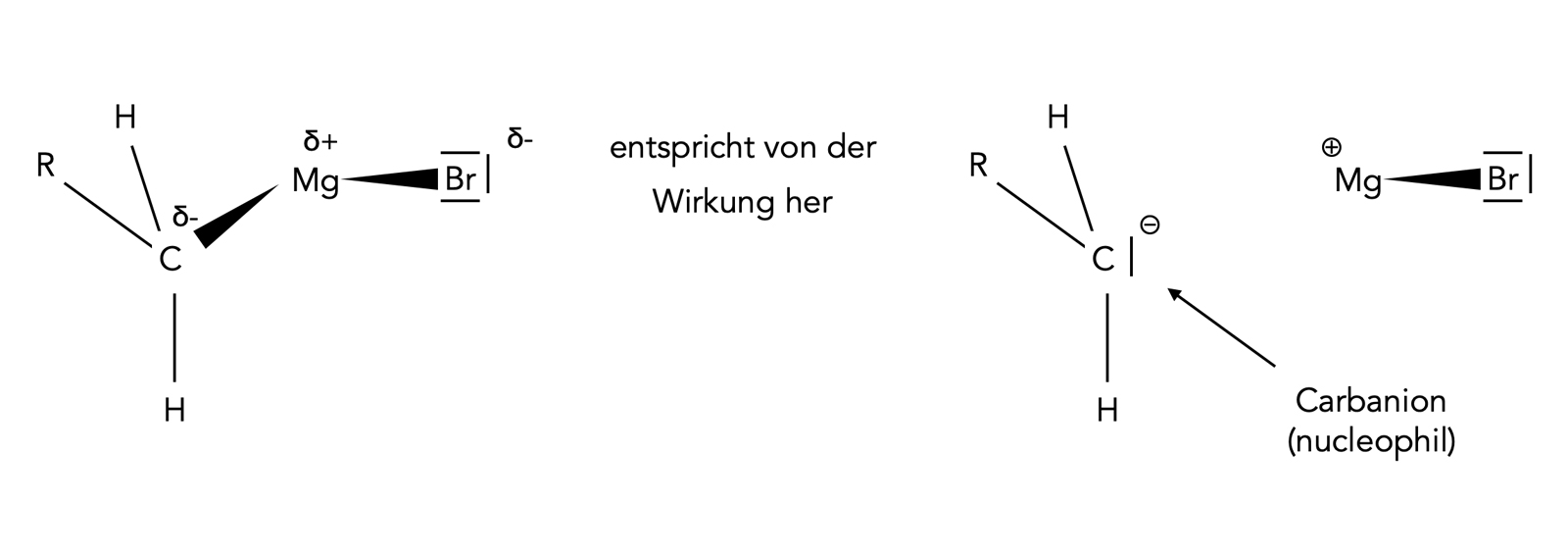
Eine Grignard-Verbindung entspricht formal einem nucleophilen Carbanion
Autor: Ulrich Helmich 07/2023, Lizenz: Public domain
Wenn man sich eine Grignard-Verbindung näher anschaut, sieht man leicht, dass sie von der Wirkung her einem Carbanion entspricht. Das C-Atom des Alkylrestes ist derart stark negativ polarisiert, dass es die Eigenschaften eines Carbanions hat und nucleophile Reaktionen eingehen kann.
Tetraedrisches Mg-Atom
Noch eine interessante Sache findet man in der engl. Wikipedia und auch im Buddrus/Schmidt: Das Mg-Atom einer Grignard-Verbindung geht auch Bindungen mit dem Ether ein, in dem die Verbindung gelöst ist. In der Wikipedia findet man dazu folgende schöne Zeichnung:
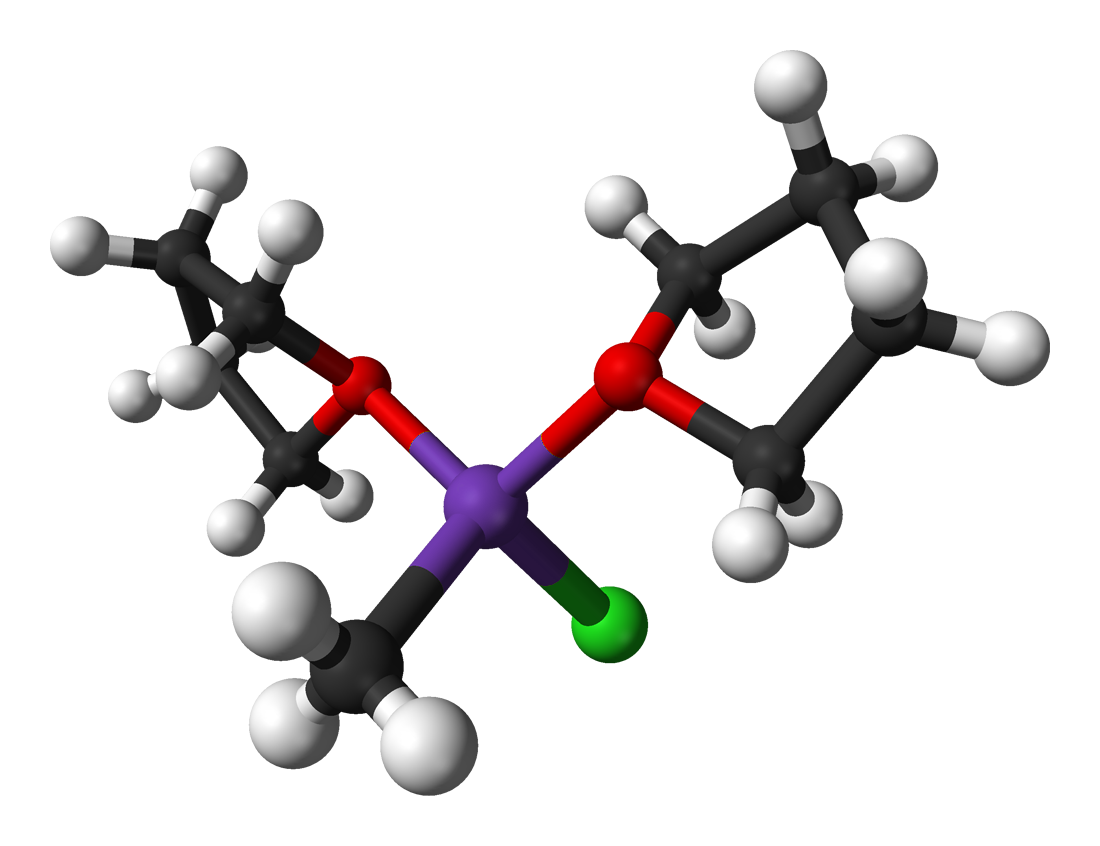
Eine Grignard-Verbindung entspricht formal einem nucleophilen Carbanion
Benjah-bmm27, Public domain, via Wikimedia Commons, Farbe des Mg-Atoms verändert von U. H elmich
Das Mg-Atom (violett) besitzt eine kovalente Bindung zu dem Alkylrest (unten links, ein Methylrest) und eine kovalente Bindung zu dem Halogen-Atom (unten rechts, grün). Darüber hinaus werden aber auch zwei kovalente Bindungen zu den O-Atomen (rot) des Ethers ausgebildet.
Schlenk-Gleichgewicht
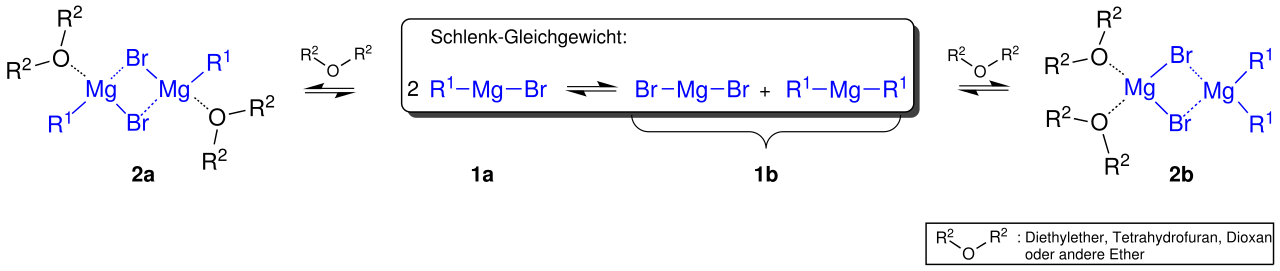
Das Schlenk-Gleichgewicht
????? ??????, Public domain, via Wikimedia Commons
Die Sache ist sogar noch ein wenig komplexer. Wie man auf dem obigen Bild sieht, bilden zwei Moleküle der Grignard-Verbindung einen losen Komplex, der im Gleichgewicht mit der R-Mg-X-Form steht, die ihrerseits im Gleichgewicht mit einer X-Mg-X-Form und einer R-Mg-R-Form steht, und diese beiden Formen stehen wiederum im Gleichgewicht mit einer weiteren Form. Dieses komplizierte Gleichgewicht, das Sie nicht unbedingt verstehen müssen (ich selbst habe da auch meine Probleme) wird als Schlenk-Gleichgewicht bezeichnet.
1.2.1.4 Warum muss das Lösemittel absolut wasserfrei sein?
Grignard-Verbindungen sind äußerst reaktiv. Mit Verbindungen, die auch nur im entferntesten Sinne eine Brönsted-Säure sind, also Protonen abgeben können, findet sofort eine Reaktion statt. Und Wasser ist schon eine relativ starke Brönsted-Säure, zumindest im Vergleich zu organischen Verbindungen wie Ethanol, Aceton oder Alkanen.
R-Mg-X + H-OH → R-H + X-Mg-OH
Das Mg-X-Atompaar löst sich von dem Alkylrest, und das entstehende Carbanion ist eine starke Base, die sich mit einem Proton verbindet, das aus der Brönsted-Säure H2O stammt. Auch mit anderen Brönsted-Säuren HA reagieren Grignard-Verbindungen analog, zum Beispiel mit Ethanol.
1.2.2 Grignard-Reaktionen
Grignard-Verbindungen reagieren formal wie ein Carbanion. Carbanionen besitzen ein negativ geladenes, sp3-hybridisiertes C-Atom mit einem freien Elektronenpaar. Carbanionen sind daher gute Nucleophile und können nucleophile Substitutionen und Additionen eingehen. Besonders reaktiv sind tertiäre Carbanionen bzw. tertiäre Grignard-Verbindungen. Das negativ geladene C-Atom zeichnet sich schon durch eine hohe Elektronendichte aus, und drei +I-Substituenten erhöhen diese Elektronendichte noch mehr
Wenn Sie mehr über Carbanionen erfahren wollen, gehen Sie doch einfach auf diese Seite in meinem Chemie-Lexikon.
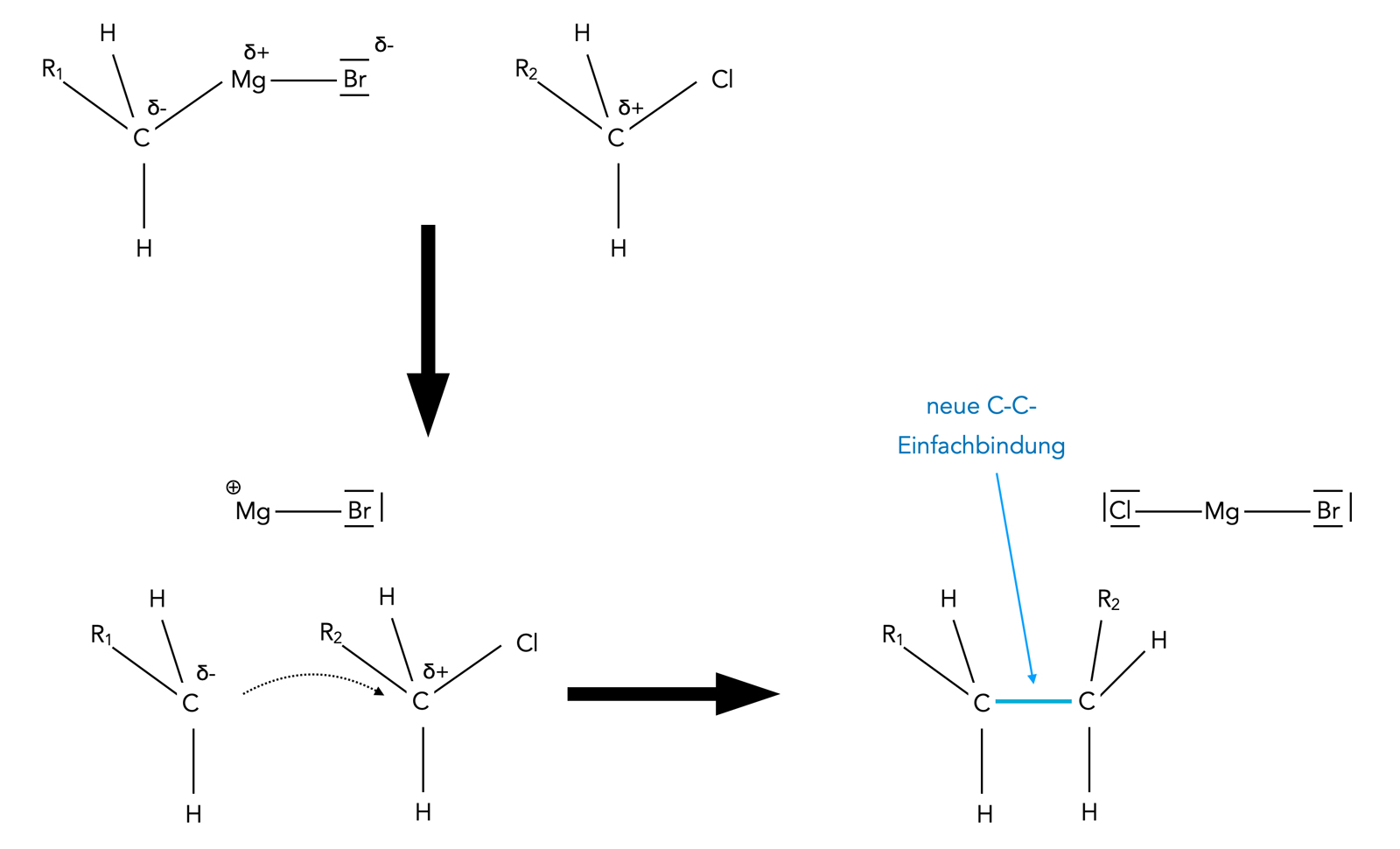
Bildung einer neuen C-C-Einfachbindung
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Hier sehen wir, wie eine primäre Grignard-Verbindung mit einem primären Halogenalkan reagiert. Das Entscheidende bei dieser nucleophilen Substitution ist die Bildung einer neuen C-C-Einfachbindung in wenigen Schritten.
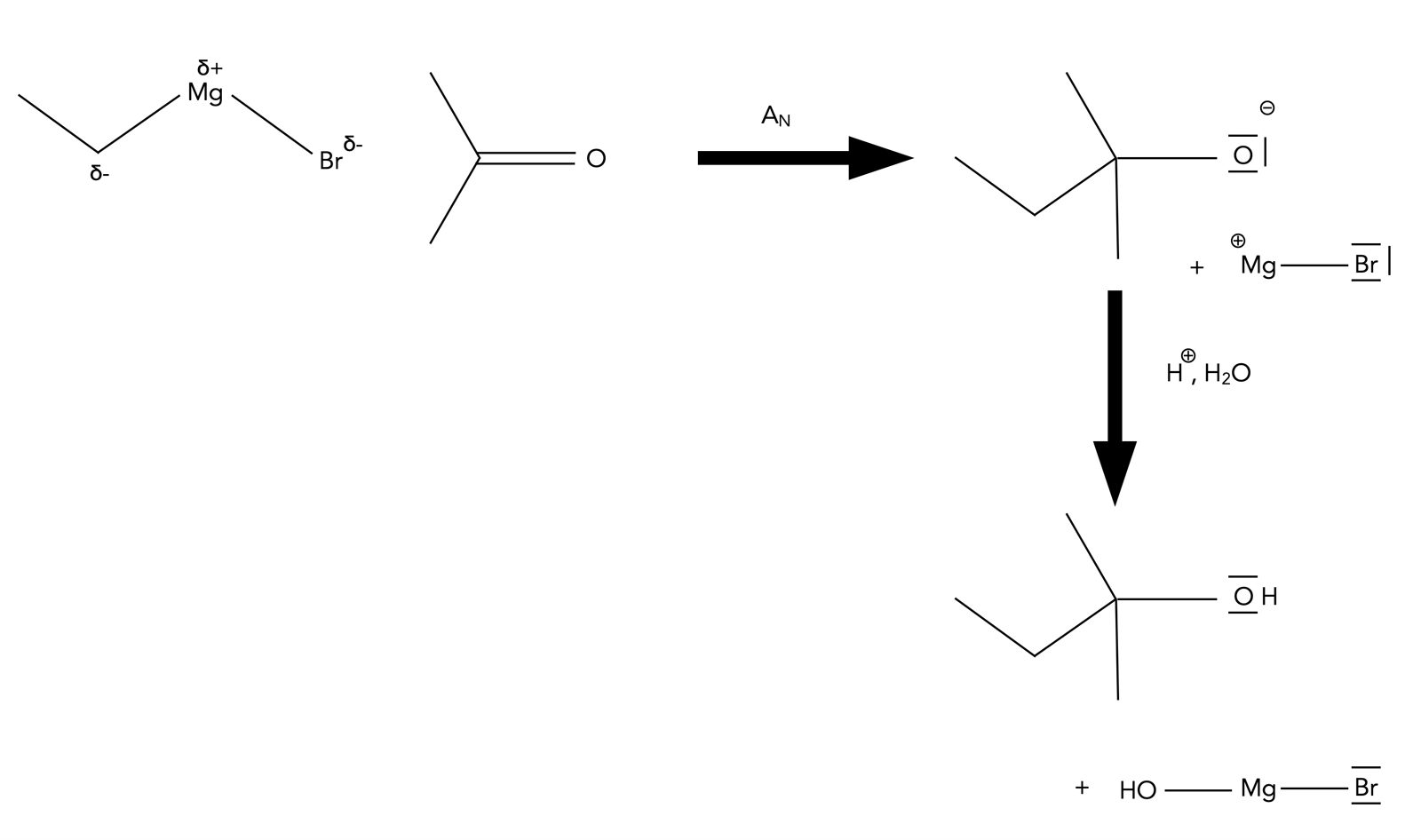
Bildung eines Alkohols aus einer Carbonylverbindung (Aldehyd oder Keton)
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Hier sehen wir ein Beispiel für eine nucleophile Addition. Das Carbanion aus der Grignard-Verbindung greift die C=O-Doppelbindung einer Carbonylverbindung an. Im Falle eines Aldehyds entsteht ein sekundärer Alkohol, im Falle eines Ketons ein tertiärer. Verwendet man Formaldehyd (Ethanal) als Carbonylverbindnug, erhält man einen primären Alkohol [2, Kap. 8.7].
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- Engl. Wikipedia, Artikel "Grignard reagent".
- Wikipedia, Artikel "Schlenk-Gleichgewicht".
Seitenanfang -
Weiter mit der Nomenklatur der Halogenalkane...