Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
-
funktionelle Gruppen verschiedener Stoffklassen und ihre Nachweise:
Hydroxy-Gruppe,Carbonyl-Gruppe, Carboxy-Gruppeund Ester-Gruppe
*nach dem Kernlehrplan des Landes NRW 2022
Typische Reaktionen
Gibt man ein Stück Magnesiumband in ein Reagenzglas mit verdünnter Essigsäure, so setzt eine heftige Reaktion ein. Im Reagenzglas steigen viele Blasen eines farblosen Gases auf, das man mit Hilfe der Knallgasprobe leicht als Wasserstoff identifizieren kann. Bei dieser Reaktion bildet sich aus Magnesium und Essigsäure das Salz Magnesiumacetat:
2 CH3-COOH + Mg → (CH3-COO)2Mg + H2
Magnesiumacetat besteht aus Mg2+-Kationen und CH3-COO--Anionen.
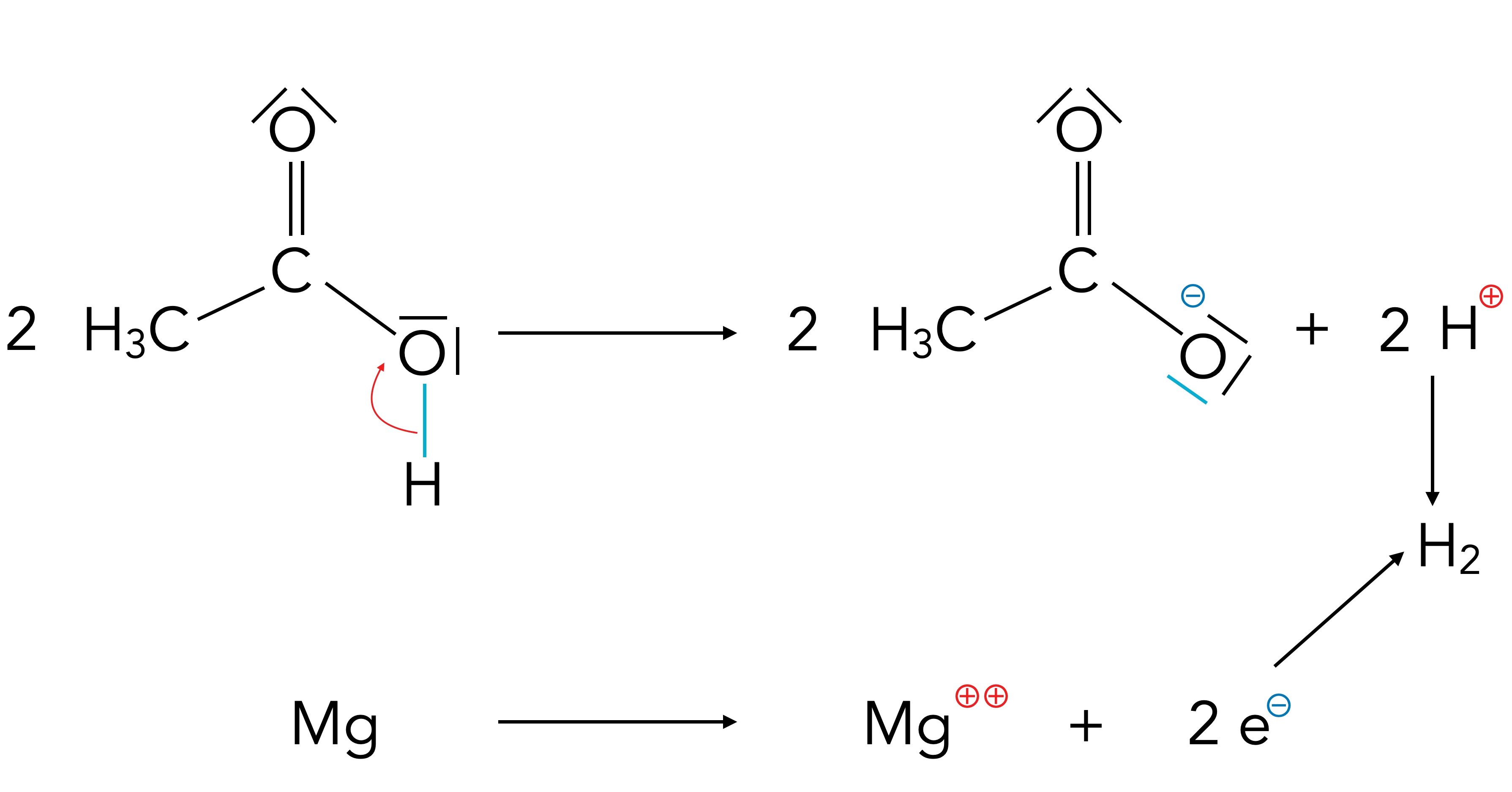
Schematische Darstellung der Reaktion von Mg mit Essigsäure
Autor: Ulrich Helmich 02/2025, Lizenz: Public domain
Dieses Bild zeigt die Umsetzung von Essigsäure mit Magnesium.
Die Magnesium-Kationen entstehen, indem die Magnesium-Atome je zwei Elektronen abgeben. Es handelt sich also um eine typische Oxidation (Elektronenabgabe).
Die Acetat-Anionen entstehen aus den Essigsäure-Molekülen, indem jedes Essigsäure-Molekül ein Proton abgibt.
Die vom Magnesium freigesetzten Elektronen vereinigen sich dann mit den von der Essigsäure abgegebenen Protonen zu gasförmigem Wasserstoff H2. Hierbei handelt es sich um eine Reduktion (Elektronenaufnahme).
Aufgabe 1*
*Diese Aufgabe ist für Schüler(innen), die bereits Kenntnisse über Säure-Base-Reaktionen (Protolysen) haben.
Begründen Sie, wieso es sich bei der Reaktion von Magnesium mit Essigsäure zwar um eine Redoxreaktion, nicht jedoch um eine Säure-Base-Reaktion (Protolyse) handelt.
Hier eine Lösung dieser Aufgabe.
Alkansäuren haben saure Eigenschaften
Alkansäuren sind Protonen-Donatoren, sie können das H-Atom der OH-Gruppe leicht als Proton abgeben. Dies erklärt die sauren Eigenschaften der Alkansäuren:
- Universalindikator schlägt nach rot um
- Mit unedlen Metallen werden unter H2-Freisetzung Salze gebildet
- Sie können mit Laugen wie NaOH neutralisiert werden
- Sie leiten den elektrischen Strom
Ein interessanter Versuch
Säuren leiten den elektrischen Strom, weil sie in wässriger Lösung in Protonen und Säurerest-Anionen zerfallen, die elektrisch geladen sind und sich daher als Ladungsträger eignen.
Bei einem Versuch werden 50 ml konz. Essigsäure in ein großes Becherglas (1000 ml oder größer) gegeben und mit einer Leitfähigkeits-Messapparatur wird die elektrische Leitfähigkeit dieser Flüssigkeit geprüft. Man stellt dabei eine nur sehr geringe Leitfähigkeit fest.
Nun wird die konzentrierte Essigsäure nach und nach mit immer mehr Wasser verdünnt. Man beobachtet jetzt, dass die elektrische Leitfähigkeit kontinuierlich ansteigt.
Wenn man diesen Versuch richtig erklären will, muss man ein wenig Ahnung von Säure-Base-Chemie haben.
Ein bisschen Säure-Base-Chemie
Eine Säure kann ihr H-Atom nur dann als Proton abgeben, wenn eine Base vorhanden ist, die bereit ist, dieses Proton aufzunehmen. Oder wenn ein Elektronen-Donator zur Verfügung steht, der die abgegebenen Protonen zu gasförmigem Wasserstoff H2 reduziert.
Gibt man eine Säure in ein Becherglas mit Wasser, so stehen jede Menge Basen-Moleküle zur Verfügung, nämlich die H2O-Moleküle. Jedes H2O-Molekül besitzt am O-Atom zwei freie Elektronenpaare, und diese können nun mit der leeren Elektronenhülle eines Protons überlappen. Dabei entstehen Oxonium-Ionen H3O+.
Nun zu den Beobachtungen des obigen Versuchs.
In reiner konz. Essigsäure ist keine Base H2O vorhanden, daher können die Essigsäure-Moleküle auch kein Proton abgeben und auf eine Base übertragen.
Verdünnt man die Essigsäure jedoch mit Wasser, sind plötzlich jede Menge Basen-Moleküle vorhanden, die Essigsäure-Moleküle dissoziieren und geben ihre Protonen an die Wasser-Moleküle ab. Es entstehen negativ geladene Säurerest-Anionen und positiv geladene Oxonium-Ionen, die den Strom leiten können.
Aufgabe 2
In einem Versuch wird ein Reagenzglas mit konz. Essigsäure gefüllt, ein anderes Reagenzglas mit verdünnter Salzsäure.
Dann wird in beide Reagenzgläser ein gleich langer Streifen Magnesiumband gegeben.
Karl Schlau, ein Schüler, der immer gut aufgepasst hat, meint nun: "Natürlich wird das Magnesiumband in der konzentrierten Säure schneller zersetzt als in der verdünnten".
Diskutieren Sie diese Behauptung von Karl.
Die Namen der Säurereste
Wenn eine Alkansäure das H-Atom der OH-Gruppe als Proton abgibt, bleibt ein negativ geladener Säurerest R-COO- über. Die so entstehenden Säurereste haben oft Trivialnamen, weil sie bekannte und wichtige Salze bilden wie zum Beispiel Natriumacetat, das Natriumsalz der Essigsäure.
Hier ein Überblick über die Namen und Trivialnamen der erstem sechs Alkansäuren und ihrer Salze.
| IUPAC-Name der Alkansäure |
Trivialname der Alkansäure |
IUPAC-Name des Säurerestes |
Trivialname des Säurerestes |
|
Methansäure |
Ameisensäure | Methanoat | Formiat |
| Ethansäure | Essigsäure | Ethanoat | Acetat |
| Propansäure | Propionsäure | Propanoat | Propionat |
| Butansäure | Buttersäure | Butanoat | Butyrat |
| Pentansäure | Valeriansäure | Pentanoat | Valerat |
| Hexansäure | Capronsäure | Hexanoat | Capronat |
Das Salz, das sich bei der Reaktion von Zink mit Essigsäure bildet, heißt dann Zinkacetat oder Zinkethanoat, und ein Salz, das bei der Reaktion von Buttersäure mit Eisen entsteht, heißt Eisenbutanoat bzw. Eisenbutyrat.
Grundsätzlich kann man sich die IUPAC-Namen der Säuren und Salze recht leicht merken, wenn man die Namen der ersten 10 Alkane auswendig gelernt hat. Bei den Trivialnamen ist das leider nicht so einfach, allerdings sollte man die wichtigsten Trivialnamen ebenfalls kennen, denn sie werden oft auch in der wissenschaftlichen Fachliteratur verwendet. In dem Lehrbuch "Organische Chemie" von Vollhardt/Schore, einem bekannten Hochschullehrbuch, kommt beispielsweise in der Kindle-Ausgabe das Wort "Ethansäure" kein einziges Mal vor, das Wort "Essigsäure" dagegen über hundert mal.