Allgemeines
Cholinerge Neuronen sind Nervenzellen, die in ihren synaptischen Endknöpfchen Acetylcholin als Neurotransmitter produzieren und freisetzen. Cholinerge Synapsen befinden sich in einigen Gehirnbereichen (vor allem im basalen Vorderhirn) und sind erregend. Hauptsächlich aber ist Acetylcholin der Neurotransmitter in den motorischen Endplatten der quergestreiften Skelettmuskulatur.
Synthese von Acetylcholin
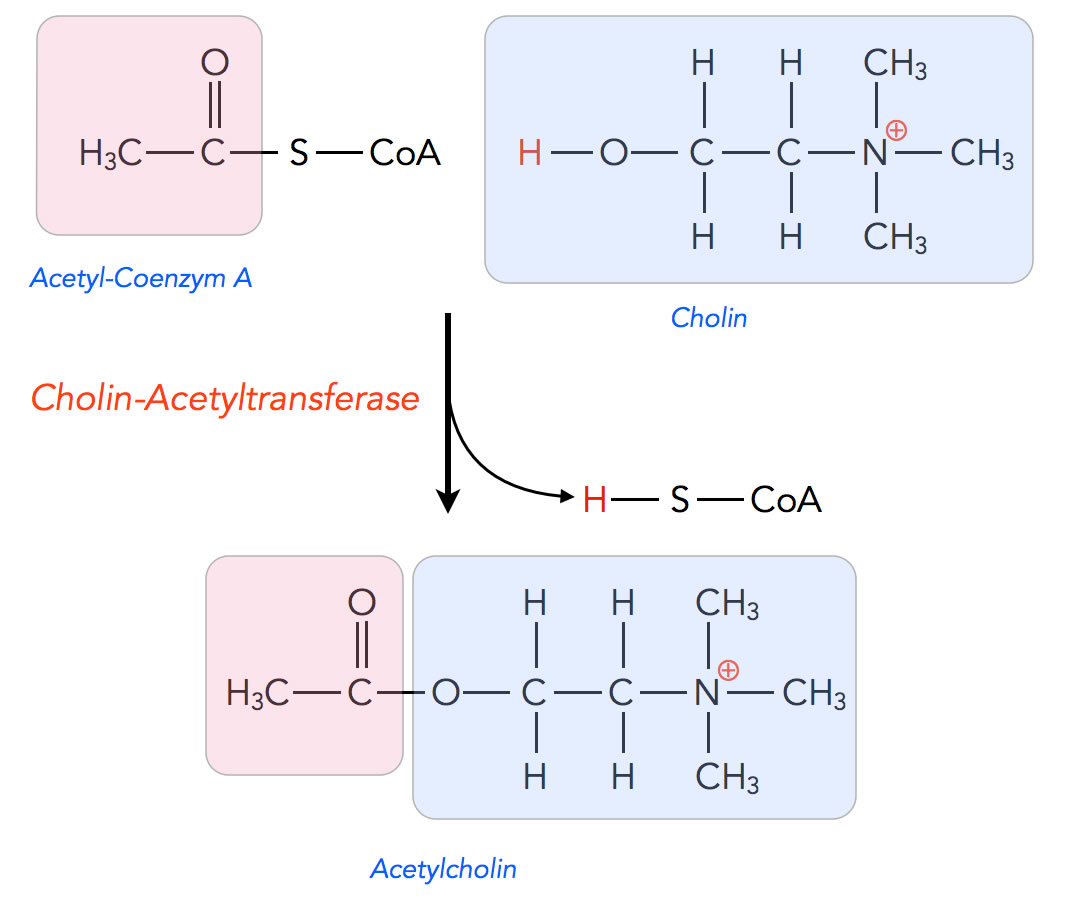
Synthese des Acetylcholins
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Der Neurotransmitter Acetylcholin, der Transmitter der motorischen Endplatte, wird in den Neuronen aus den beiden allgegenwärtigen Verbindungen Acetyl-Coenzym A und Cholin hergestellt, und zwar von dem Enzym Cholin-Acetyltransferase.
Acetyl-Coenzym A kennen wir als Zwischenprodukt der aeroben Dissimilation. Acetyl-CoA wird aus Pyruvat hergestellt, dem Endprodukt der Glycolyse, und fließt dann in den Citratzyklus ein, wo es seinen Essigsäure-Rest an den Akzeptor Oxalacetat abgibt.
Das Cholin kennen wir als Bestandteil der Lecithine, das sind sehr wichtige Membranlipide, also Bausteine einer jeden Zellmembran.
Das Enzym Cholin-Acetyltransferase wird im Soma der Neurone synthetisiert und dann über den axonalen Transport in die synaptischen Endknöpfchen transportiert. Dort findet dann die Synthese des Neurotransmitters statt.
Das Cholin muss von dem synaptischen Endknöpfchen aktiv aufgenommen werden, allerdings ohne ATP-Verbrauch. Es findet nämlich ein Cotransport statt: Natrium-Ionen fließen passiv mit dem Konzentrationsgradienten in die Zelle, und die in dem Na+-Gradienten gespeicherte Energie wird genutzt, um die Cholin-Moleküle gegen ihr Konzentrationsgefälle in die Zelle zu transportieren [1, 2].
Freisetzung von Acetylcholin
Ein synaptisches Vesikel einer Acetylcholin-Synapse enthält mehrere Tausend Acetylcholin-Moleküle, und bei der Erregung der motorischen Endplatte fusionieren ca. 500 solcher Vesikel mit der präsynaptischen Membran. Ungefähr die Hälfte der Acetylcholin-Moleküle gelangt bis zur postsynaptischen Membran, was einer Gesamtzahl von ca. 1 Million Neurotransmitter-Molekülen entspricht, die für die Erregung eines motorischen Endplatte benötigt werden.
Die Acetylcholin-Moleküle erreichen die postsynaptische Membran in extrem kurzer Zeit. Innerhalb von 10 µs wird an der postsynaptischen Membran eine Acetylcholin-Konzentration von 10 mmol/l aufgebaut. Innerhalb der nächsten 100 µs fällt die Konzentration jedoch wieder auf 0 mmol/l ab, weil die Acetylcholinesterase (siehe nächsten Abschnitt) den Neurotransmitter schnell wieder abbaut [3, S. 118f].
Abbau von Acetylcholin
Der in den synaptischen Spalt freigesetzte Neurotransmitter muss schnell wieder abgebaut werden, damit die Informationsübertragung zwischen dem motorischen Neuron und der Muskelzelle einwandfrei funktioniert. Dazu dient das Enzym Acetylcholinesterase, das von dem synaptischen Endknöpfchen in den synaptischen Spalt abgegeben wird.
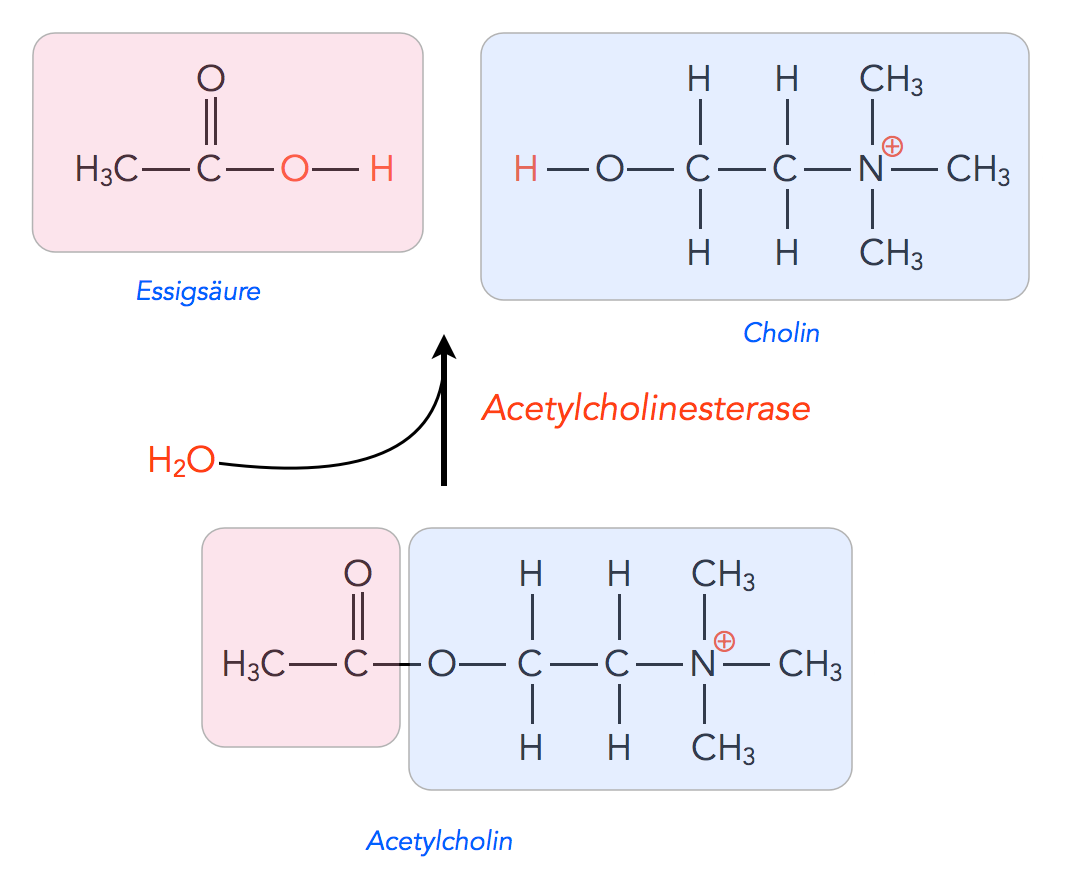
Abbau von Acetylcholin
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Acetylcholinesterase zerlegt Acetylcholin hydrolytisch in Essigsäure und Cholin, also in eine Carbonsäure und einen Alkohol. Das Cholin wird zum größten Teil über den oben beschriebenen aktiven Transport in das synaptische Endknöpfchen wieder aufgenommen, während die Essigsäure nicht wieder aufgenommen wird, es gibt im synaptischen Endknöpfchen aber keinen Mangel an Acetyl-CoA, da diese Verbindung im Rahmen der Glycolyse ständig in den Zellen hergestellt wird.
Einwirkung von Drogen und Medikamenten, Teil 1
Viele Drogen und Medikamente hemmen die Acetylcholinesterase, so dass sich der Neurotransmitter Acetylcholin im synaptischen Spalt anhäuft. Die Signalübertragung an den cholinergen Synapsen der Muskulatur (auch der Herzmuskulatur) wird dadurch unterbrochen. Zunächst nehmen die Herzfrequenz und der Blutdruck stark zu, bei weiterer Hemmung der Acetylcholinesterase tritt dann unweigerlich der Tod ein (Atemlähmung, Herzstillstand).
Ein reversibler Hemmstoff der Acetylcholinesterase ist zum Beispiel Physostigmin, das teilweise als Medikament gegen den grünen Star verwendet wird. Es setzt den Augeninnendruck herab und ist in entsprechenden Augentropfen enthalten [4].
Bei bestimmten Krankheiten, die auf einem Mangel an Acetylcholin beruhen wie zum Beispiel der schweren Muskelschwäche (Myasthenia gravis), werden reversible Acetylcholinesterase-Hemmstoffe injiziert, so dass sich genug Acetylcholin im synaptischen Spalt ansammeln kann, um die Muskeln zu erregen [3, S. 119].
Die meisten Acetylcholinesterase-Hemmer sind jedoch nicht reversibel, sondern irreversibel. Verschiedene chemische Kampfstoffe wie Soman sind solche irreversiblen Acetylcholinesterase-Hemmer, aber auch verschiedene Insektizide [3, S. 119].
Die zwei Typen der ACh-Rezeptoren
Bisher hatten wir die präsynaptische Seite des cholinergen Neurons behandelt, also Produktion und Freisetzung des Neurotransmitters Acetylcholin sowie den enzymatischen Abbau desselben durch die Acetylcholinesterase, ein Enzym, das der Wirkort vieler Medikamente und Drogen ist.
Nun wollen wir die postsynaptische Seite der cholinergen Nervenzellen näher kennenlernen. Wie sehen die Acetylcholin-Rezeptoren aus?
Bei der Untersuchung von Synapsen, die mit dem Neurotransmitter Acetylcholin arbeiten, fand man schon recht für über neuropharmakologische Analysen heraus, dass es zwei völlig verschiedene Acetylcholin-Rezeptoren gibt, den nikotinischen und den muscarinischen:
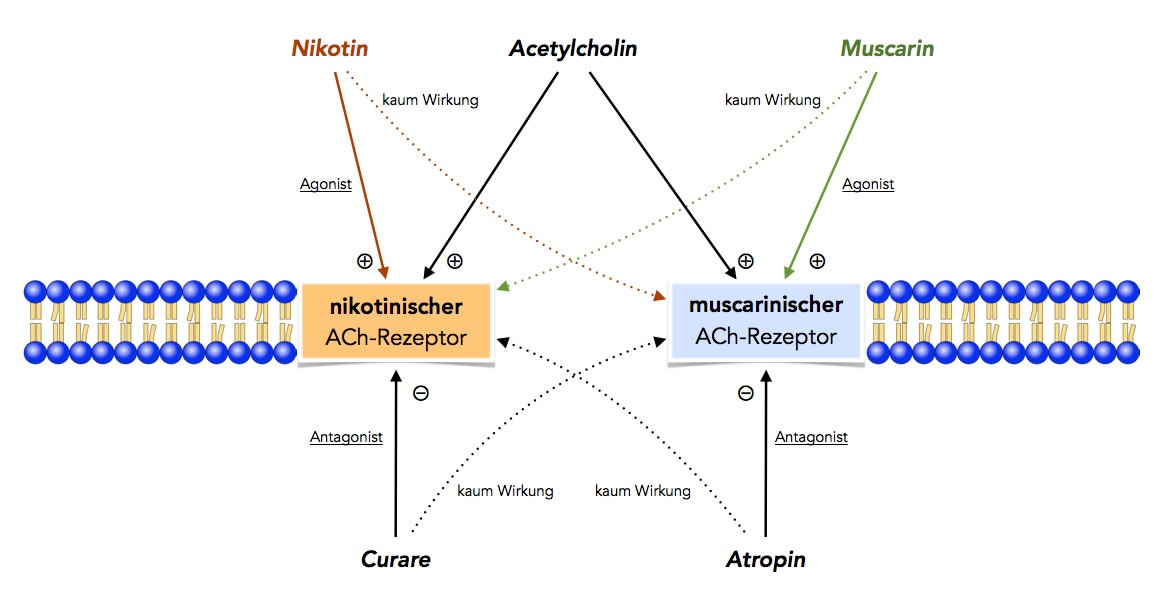
Die zwei Arten der ACh-Rezeptoren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Acetylcholin wirkt auf beide Rezeptor-Typen. Nikotin, ein Gift aus der Tabakpflanze, wirkt ähnlich wie Acetylcholin auf den einen Rezeptortyp, der daher als nikotinischer Acetylcholin-Rezeptor bezeichnet wird.
Muscarin, ein Gift aus einem Pilz, wirkt auf den anderen Rezeptortyp, der dann als muscarinischer Acetylcholin-Rezeptor bezeichnet wird. Nikotin hat so gut wie keine Wirkung auf den muscarinischen Rezeptor, und umgekehrt hat Muscarin so gut wie keine Wirkung auf den nikotinischen Rezeptor.
Beide Giftstoffe werden als Agonisten bezeichnet, weil sie die gleiche oder eine ähnliche Wirkung haben wie der eigentliche Neurotransmitter Acetylcholin.
Neben diesen Agonisten gibt es auch noch zwei Antagonisten, also Verbindungen, welche die Wirkung von Acetylcholin aufheben bzw. hemmen, und zwar Curare, das aus Giftfröschen gewonnene Pfeilgift südamerikanischer Indianer, und Atropin, ein Gift der Tollkirsche. Curare hemmt nur den nikotinischen Rezeptor, wirkt aber so gut wie nicht auf den muscarinischen, und umgekehrt blockiert Atropin den muscarinischen Rezeptor, aber nicht den nikotinischen.
Herausgefunden hat man die Existenz dieser beiden Rezeptoren durch pharmakologische Untersuchungen von Skelettmuskulatur und Herzmuskulatur. Acetylcholin hat völlig entgegengesetzte Wirkungen auf die beiden Muskeltypen. Auf die Skelettmuskulatur wirkt ACh erregend, auf die Herzmuskulatur dagegen hemmend.
Die erregende Wirkung auf die Skelett-Muskelzellen erklärt sich durch den Einstrom von Natrium-Ionen und die darauf folgende Depolarisierung der Muskelzellen (nikotinischer Acetylcholin-Rezeptor). Die hemmende Wirkung auf die Herz-Muskelzellen kommt dadurch zustande, dass Acetylcholin an Rezeptoren bindet, die auf Umwegen Kalium-Kanäle öffnen, so dass Kalium-Ionen aus der Zelle herausströmen und deren Membran hyperpolarisieren. Die Herzfrequenz sinkt daher.
Der nikotinische ACh-Rezeptor
Diesen Rezeptortyp hatten wir bereits bei der Behandlung der "Schulbuchsynapse" kurz erwähnt (siehe "Funktion der motorischen Endplatte"), aber noch nicht richtig besprochen.
Der nikotinische Acetylcholin-Rezeptor der motorischen Endplatte besteht aus fünf Protein-Untereinheiten, die als α, β, γ und δ bezeichnet werden. Die alpha-Untereinheit kommt zweimal in dem Rezeptor vor, die Zusammensetzung ist also α2βγδ. Das Acetylcholin wird von den beiden α-Untereinheiten gebunden. Der Na+/K+-Kanal in der Mitte des Rezeptorproteins öffnet sich nur, wenn beide α-Untereinheiten mit je einem Acetylcholin-Molekül besetzt sind.
Auch im Gehirn gibt es nikotinische Acetylcholin-Rezeptoren. Diese bestehen ebenfalls aus fünf Untereinheiten, allerdings nur aus alpha- und beta-Untereinheiten mit der Zusammensetzung α3β2. Ob jetzt tatsächlich drei Acetylcholin-Moleküle notwendig sind, um diesen Rezeptor zu aktivieren, geht aus der zur Verfügung stehenden Literatur leider nicht hervor.
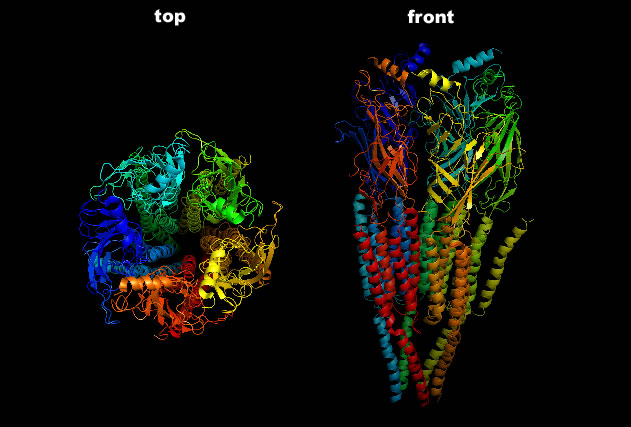
Der nikotinische ACh-Rezeptor aus dem Zitterrochen (Torpedo) in Seitenansicht (rechts) und Draufsicht (links) nach PDB 2BG9
Autor: S. Jähnichen assumed, Lizenz: public domain.
Hier sieht man den nikotinischen ACh-Rezeptor einmal in Aufsicht (links), und einmal von der Seite (rechts).
Kinetik / Arbeitsweise des Rezeptors
Grundsätzlich unterscheidet man bei dem ACh-Rezeptor zwei Zustände: Offen und geschlossen. Normalerweise ist der Rezeptor geschlossen. Setzt sich ein ACh-Molekül in eine der beiden alpha-Einheiten, so geht der Rezeptor noch nicht in den offenen Zustand über, sondern in eine Art "Wartezustand 1". Erst wenn sich ein zweites ACh-Molekül an die zweite alpha-Untereinheit bindet, geht der Rezeptor in einen "Wartezustand 2" über, der dann aber sehr schnell in den geöffneten Zustand übergeht.
In der Wikipedia findet sich dazu eine brauchbare Abbildung:
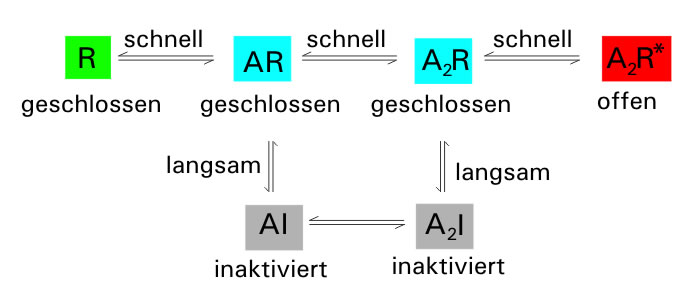
Konformationen bzw. Zustände des ACh-Rezeptors
R=geschlossene, jedoch aktivierbare Form des Rezeptors; A = Acetylcholin; R* = offener Zustand; I= inaktiver Zustand
Autor: Opossum58, Lizenz: Creative Commons Attribution-Share Alike 3.0 Unported license.
Die "Wartezustände" werden hier als AR und A2R bezeichnet, der geöffnete Zustand als A2R*. Man achte darauf, dass es sich bei den Reaktionspfeilen um Gleichgewichtspfeile handelt. In der Tat ist jeder Übergang zwischen den Zuständen reversibel.
In Schulbüchern wird dann oft das Ping-pong-Beispiel herangezogen, dass also die Acetylcholin-Moleküle wie Ping-pong-Bälle im synaptischen Spalt umherspringen, mal rein in den Rezeptor, dann wieder raus aus dem Rezeptor. Eine kompetitive Hemmung durch ACh-Antagonisten kann man mit dieser Sichtweise allerdings sehr gut erklären, das ist wahrscheinlich auch der Grund dafür, dass diese Darstellung in Schulbüchern oft verwendet wird.
Der muscarinische ACh-Rezeptor (M2 und M4)
Säugetiere besitzen fünf verschiedene muscarinische ACh-Rezeptoren, die als M1 bis M5 bezeichnet werden. Die ACh-Rezeptoren der Typen M2 und M4 arbeiten noch recht unkompliziert, sogar in Schulbücher findet der Reaktionsweg Eingang. Daher soll zunächst dieser "einfache" Reaktionsweg beschrieben werden, der in der Fachliteratur auch als "verkürzter Signalweg" bezeichnet wird [1].
Der muscarinische ACh-Rezeptor ist ganz anders aufgebaut als der nikotinische. Das Protein besteht nicht aus einzelnen Untereinheiten, sondern aus einer zusammenhängenden Kette aus etwa 400–500 Aminosäuren. Das Protein besitzt sieben alpha-Helices, welche die Zellmembran durchspannen. Innerhalb und außerhalb der Zelle sind diese sieben Helices durch Peptid-Schleifen miteinander verbunden:
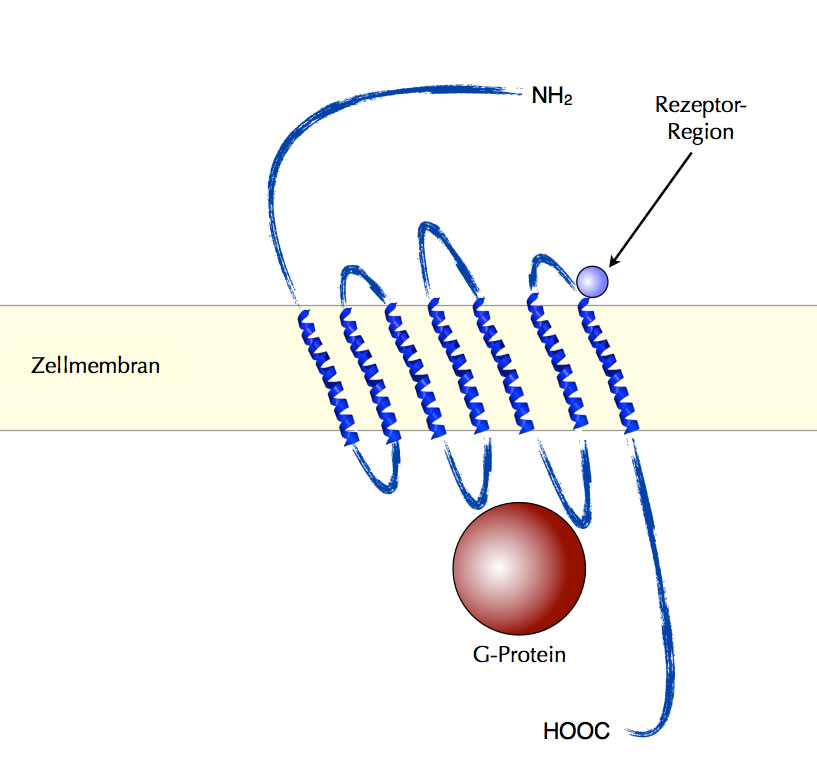
Ein Rezeptorprotein durchspannt mit 7 alpha-Helices die Membran und ist auf der Innenseite mit einem G-Protein verbunden
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Auf der Innenseite der Membran ist das Rezeptorprotein an ein G-Protein gekoppelt, so ähnlich wie auf dem obigen Bild, das ich der Lexikonseite "Betarezeptoren" entliehen habe. Bei dem muscarinischen ACh-Rezeptor binden zwei der auf der Außenseite befindlichen Schleifen das Acetylcholin, und zwei der auf der Innenseite befindlichen Schleifen binden das G-Protein.
G-Proteine
Die Bezeichnung "G-Protein" ist eine Abkürzung für "Guanosintriphosphat bindendes Protein". Alle G-Proteine können nämlich GTP bzw. GDP binden (ein Verwandter des ATP bzw. ADP). Ein G-Protein besteht immer aus drei Untereinheiten, die als α, β und γ bezeichnet werden. Die γ-Untereinheit ist allerdings recht klein. Im inaktiven Zustand ist ein GDP-Molekül an die α-Untereinheit gebunden. Wird der Rezeptor nun durch seinen Effektor aktiviert (hier also Acetylcholin), dann wird das gebundene GDP durch GTP ersetzt, das G-Protein geht sozusagen in seine aktive Form über und spaltet sich in zwei aktive Teile auf, den Komplex aus α-Untereinheit und GTP und den Komplex aus der β- und γ-Untereinheit. Beide Komplexe können dann andere Proteine aktivieren oder hemmen.
Arbeitsweise des muscarinischen ACh-Rezeptors [1, S. 179-183]
Schritt 1
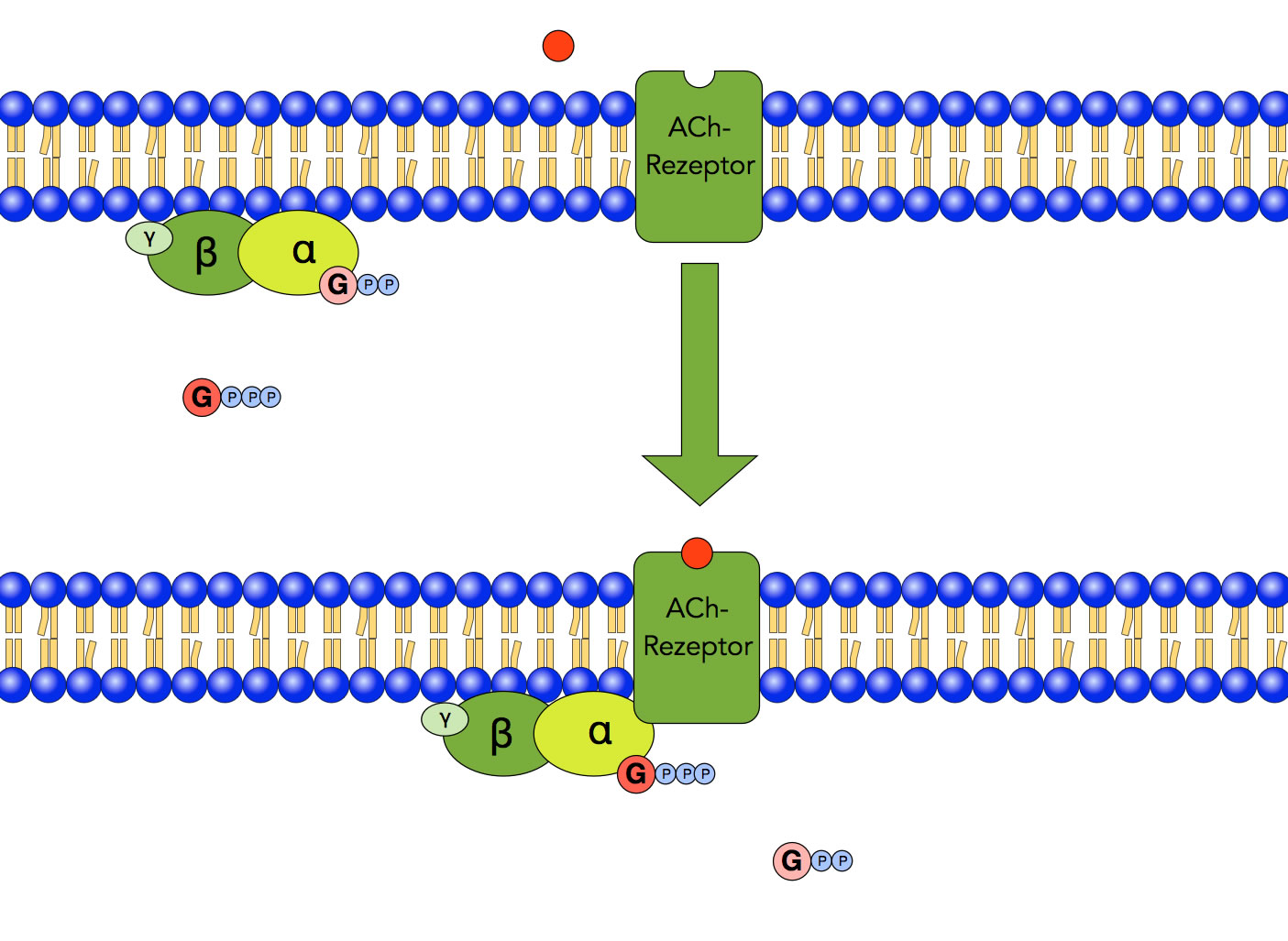
Schritt 1: Aktivierung des G-Proteins
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Im ersten Schritt der Rezeptor-Antwort setzt sich ein Acetylcholin-Molekül in das Rezeptorprotein, welches daraufhin aktiviert wird. Das G-Protein mit dem gebundenem GDP bewegt sich auf der Innenseite der Membran auf das Rezeptorprotein zu, gibt sein GDP ab und nimmt dafür ein GTP-Molekül auf. Jetzt ist das G-Protein aktiviert.
Schritt 2
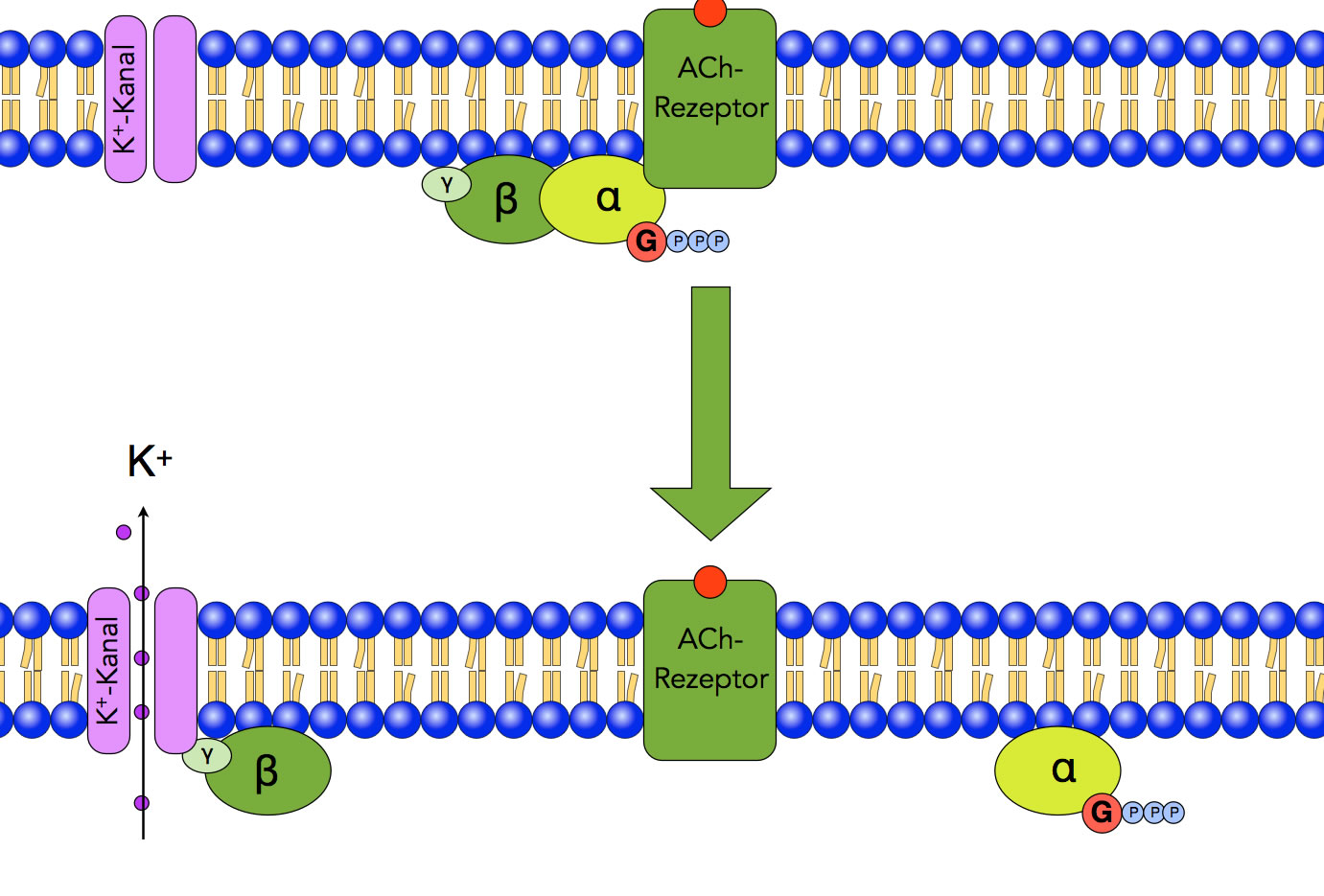
Schritt 2: Öffnen des K+-Kanals
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Im zweiten Schritt des Vorgangs spaltet sich das aktivierte G-Protein in zwei Hälften. Die eine Hälfte besteht aus dem β-γ-Komplex, die andere Hälfte aus dem α-GTP-Komplex. Der β-γ-Komplex wandert nun an der inneren Seite der Membran entlang, bis er auf einen Kalium-Kanal trifft. Dort setzt er sich in ein allosterisches Zentrum und öffnet den Kanal. Kalium-Ionen strömen nach außen und hyperpolarisieren die Membran.
Schritt 3 (nicht abgebildet):
Der α-GTP-Komplex spaltet das GTP in GDP und Pi, der β-γ-Komplex löst sich vom Kalium-Kanal, und die beiden Komplexe vereinigen sich wieder zum ursprünglichen G-Protein - bereit für die nächste Runde, also für das nächste Acetylcholin-Molekül, das an den Rezeptor andockt. Außerdem deaktiviert der α-GTP-Komplex die Adenylatcyclasen auf der Innenseite der Membran, also die Enzyme, die cAMP aus ATP herstellen. Das cAMP ist ein sekundärer Botenstoff, der vielfältige Reaktionen in der Zelle in Gang setzt, all diese Reaktionen werden durch das gebundene Acetylcholin auf diesen Umweg letzten Endes gehemmt.
Der muscarinische ACh-Rezeptor (M1, M3 und M5)
Die Arbeitsweise dieser drei Rezeptortypen ist wesentlich komplexer als der verkürzte Signalweg, den die Typen M2 und M4 einschlagen. In der Wikipedia ist dieser Reaktionsweg kurz beschrieben, ich versuche einmal, das Ganze etwas langsamer zu erklären und an geeigneter Stelle zu kommentieren. Zunächst aber einmal ein (gekürzter) Auszug aus der Wikipedia:
"Über ein G-Protein wird im ersten Schritt die membranständige Phospholipase C (PLC) aktiviert. Der Angriffspunkt dieses Enzyms ist das Phosphatidylinositol-4,5-bisphosphat (PIP2), ein Bestandteil der Zellmembran...
Die PLC spaltet von diesem Phospholipid das Inositoltrisphosphat (IP3) ab, das ins Cytoplasma diffundiert. Das verbleibende Diacylglycerin (DAG) verbleibt in der Membran.
Im Cytoplasma setzt dann IP3 aus intrazellulären Speichern des Endoplasmatischen Retikulums Ca2+ frei, wodurch eine ganze Reihe von biochemischen Prozessen in Gang gebracht wird. An das membranständige DAG kann sich die Proteinkinase C anlagern. Dabei wird unter Mitwirkung von Ca2+ dann die katalytische Domäne des Enzyms freigelegt. Über eine Phosphorylierung von Zellproteinen mit Hilfe des ATP kommen dann weitere Mechanismen in der Zelle in Gang. Beide Systeme (IP3 und DAG) können sowohl unabhängig voneinander arbeiten als auch sich gegenseitig verstärken."
Das muss man jetzt erst mal verstehen... Wie immer, versuche ich jetzt mal eine graphische Darstellung dieses Weges. Mal sehen, ob es mit dem Verständnis dann besser klappt.
Schritte 1 und 2
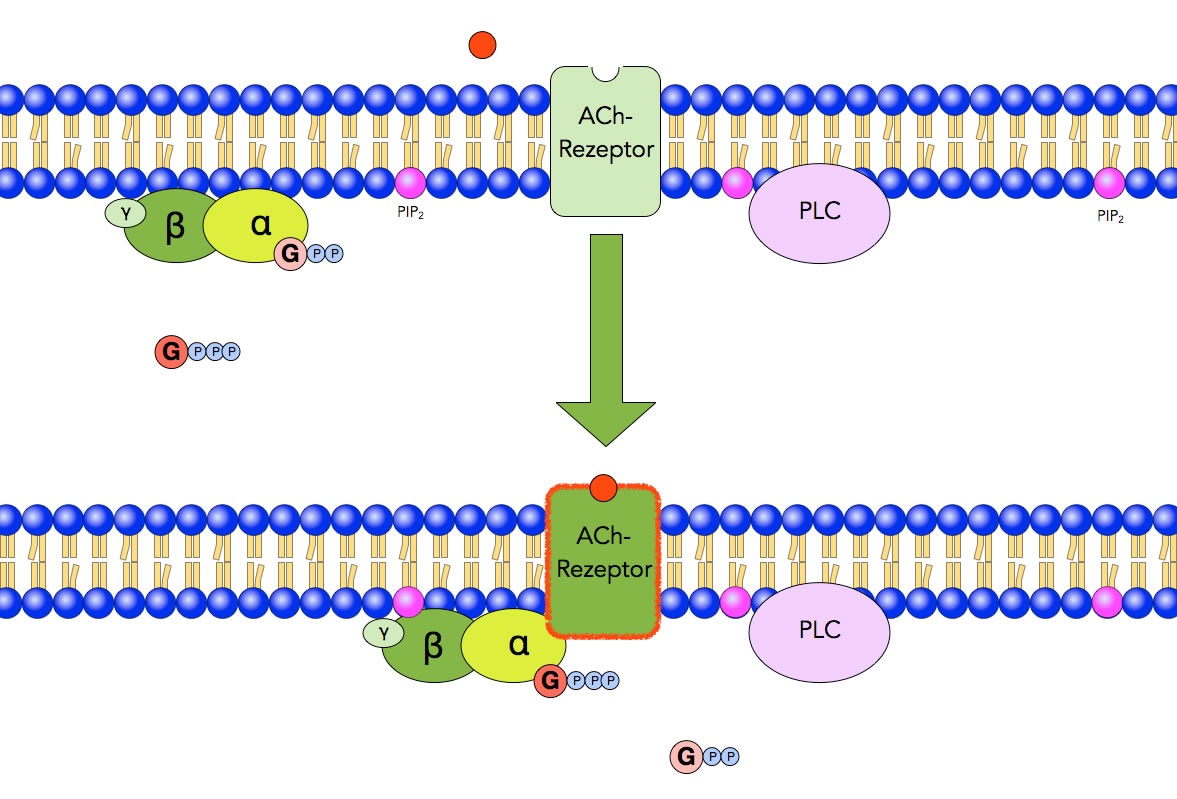
Acetylcholin setzt sich in den muscarinischen ACh-Rezeptor
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Schritt 1: Ein Acetylcholin-Molekül setzt sich in den muscarinischen ACh-Rezeptor des Typs M1, M3 oder M5.
Schritt 2: Auf der Innenseite der Membran wird ein G-Protein aktiviert. Das Enzym Phospholipase C (PCL) ist noch inaktiv.
Schritt 3
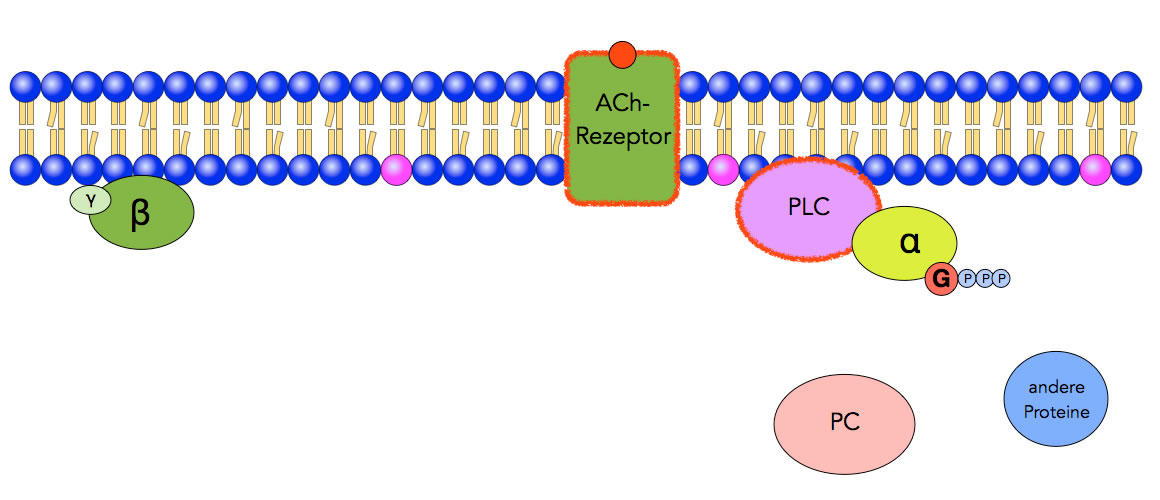
Aktivierung von PLC
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Schritt 3: Der Gα-GTP-Komplex des zerfallenen G-Proteins aktiviert die Phospholipase C. Das Enzym Proteinkinase C (PC) ist noch inaktiv, auch andere Proteine spielen noch keine Rolle.
Schritt 4
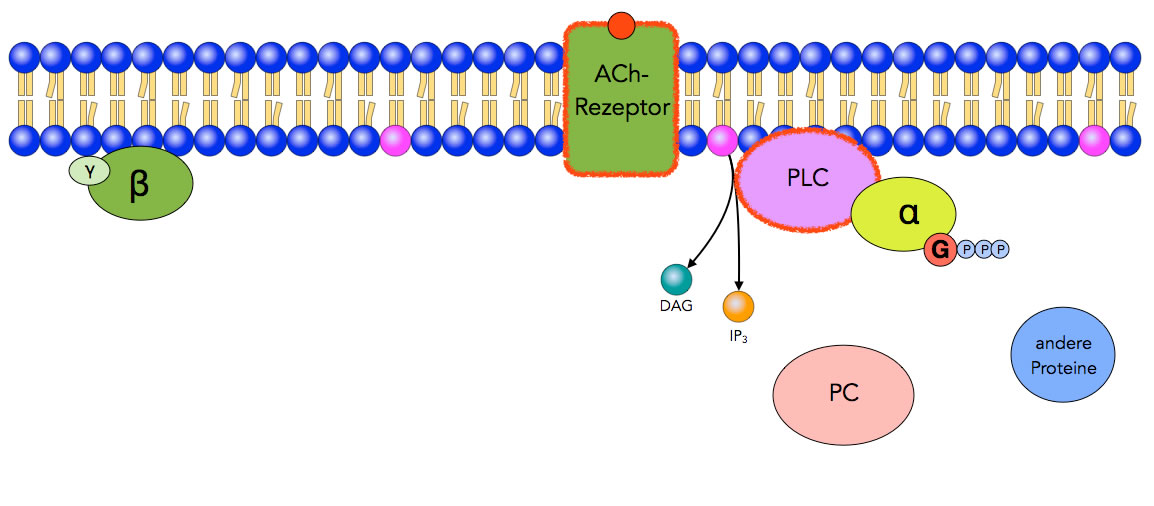
PLC spaltet PIP2
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Schritt 4: Das aktivierte Enzym Phospholipase C (PCL) spaltet das Membranlipid Phosphatidylinositol-4,5-bisphosphat (PIP2) in zwei Bestandteile, nämlich Diacylglycerin (DAG) und Inositol-1,4,5-triphosphat (IP3). Beide Verbindungen dienen in der Zelle als second messenger, können also andere Enzyme oder Proteine aktivieren (oder hemmen).
Die Phosphatidylinositole sind eine wichtige Klasse der Phosphoglyceride, die zu den Membranlipiden gehören. Einzelheiten hierzu finden Sie auf dieser Lexikonseite.
Schritte 5 und 6
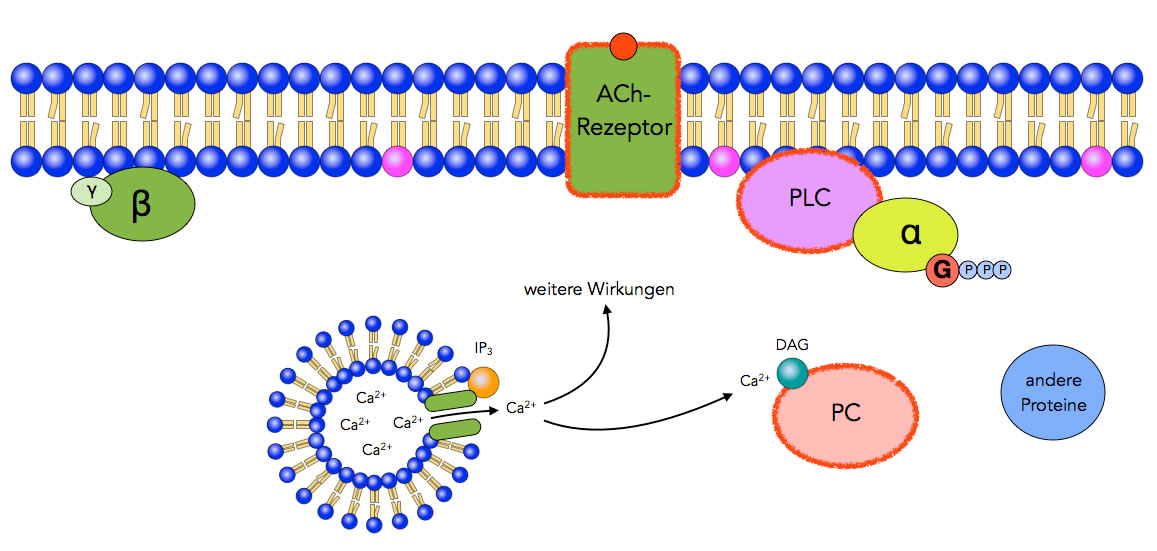
Freisetzung von Calcium-Ionen, Aktivierung von PC
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Schritt 5: Der second messenger IP3 setzt sich an Calciumkanäle des endoplasmatischen Reticulums, diese öffnen sich und Calcium-Ionen strömen in das Zellplasma.
Schritt 6: Der second messenger DAG setzt sich an das Enzym Proteinkinase C (PC) und aktiviert dieses. Calcium-Ionen unterstützen diesen Vorgang. Die Ca2+-Ionen können außerdem weitere Prozesse in der Zelle in Gang setzen, wie man ja beispielsweise bei der Fusion der synaptischen Vesikel in den synaptischen Endknöpfchen gesehen hat.
Schritt 7
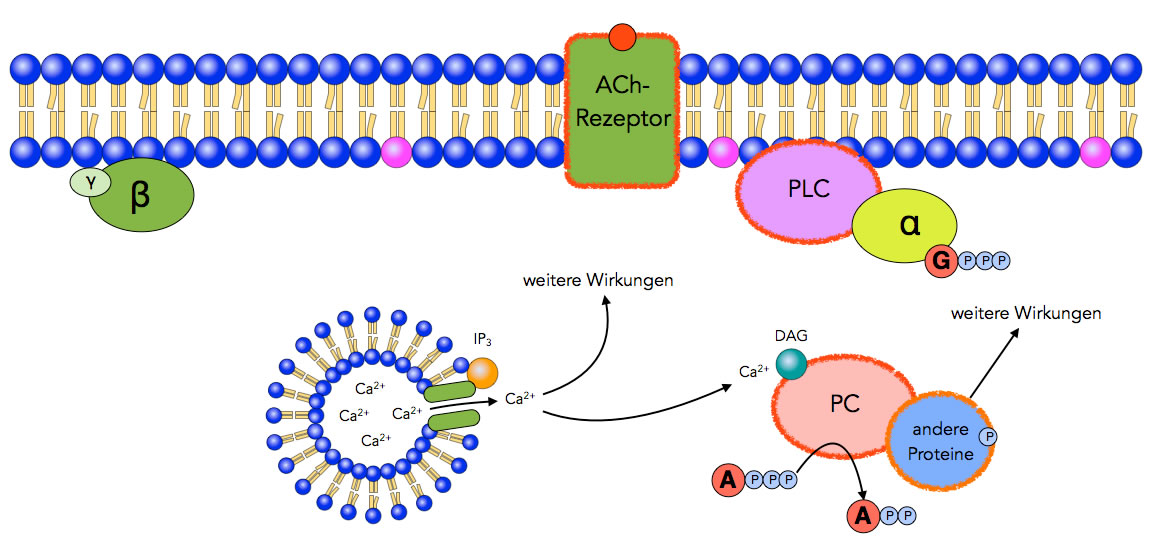
Aktivierung anderer Proteine
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Schritt 7: Die Proteinkinase C kann andere Proteine phosphorylieren, also eine Phosphatgruppe von ATP auf Proteine übertragen und diese dadurch aktivieren. Diese aktivierten Proteine können dann weitere zelluläre Prozesse in Gang setzen.
So, ich hoffe, durch diese graphischen Darstellungen habe ich die Arbeitsweise der second-messenger-Kaskaden an den muscarinischen Rezeptoren einigermaßen übersichtlich dargestellt.
Quellen:
- Bear, Connors, Paradiso: Neurowissenschaften, Springer-Verlag 2018
- Spektrum-Lexikon der Neurowissenschaften, Artikel "cholinerge Nervenzellen".
- Dudel, Menzel, Schmidt: Neurowissenschaft, Heidelberg 2001.
- Spektrum-Lexikon der Biologie, Artikel "Physostigmin".
- Wikipedia, Artikel "Nikotinischer Acetylcholinrezeptor".
- Wikipedia, Artikel "Muskarinischer Acetylcholinrezeptor".