Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- wie man nachgewiesen hat, dass die Na+/K+-Pumpe ATP-abhängig ist,
- und wie man nachgewiesen hat, dass die Na+/K+-Pumpe von der Außenkonzentration der K+-Ionen abhängig ist.
Nachweis der ATP-Abhängigkeit
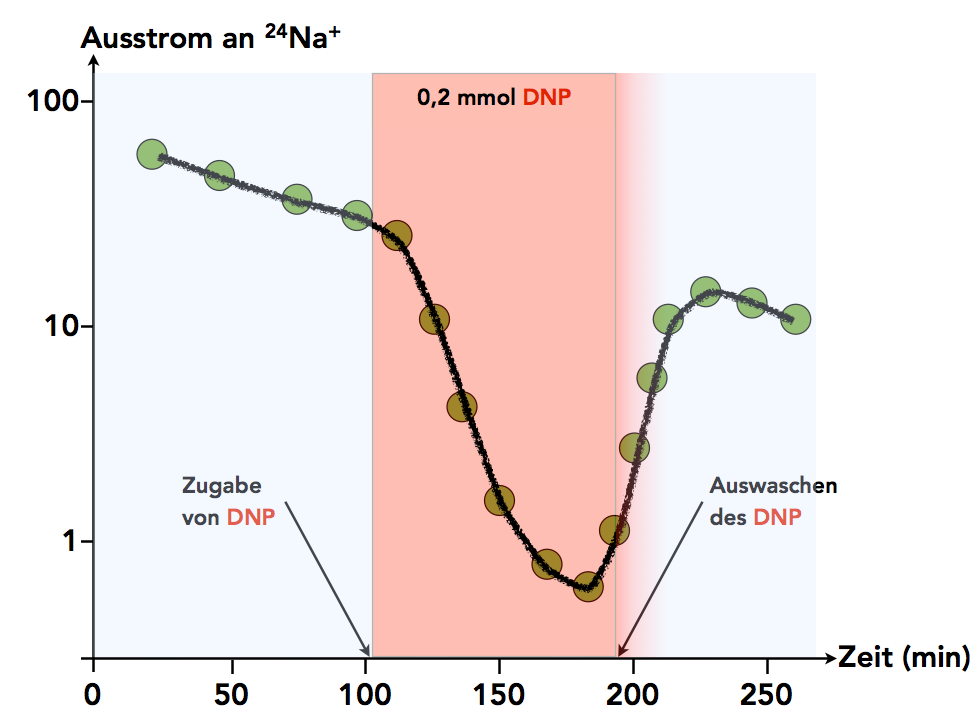
Ein Experiment zum Nachweis der Na+-K+-Pumpe in Anlehnung an eine Darstellung in Schmidt [1].
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Hier sehen Sie die Ergebnisse eines Versuchs, mit dem man nachgewiesen hat, dass Natrium-Ionen aktiv aus der Zelle herausgepumpt werden. Die Vorlage der Abbildung stammt aus dem Buch von Schmidt, dieser Autor gibt als Quelle wiederum Hodgkin und Keynes im J. Physiol. (1955) an. Der wissenschaftliche Artikel ist als PDF-Datei frei erhältlich.
Der Versuch in Einzelschritten
Zunächst hat man eine Nervenzelle in eine Lösung gelegt, die radioaktiv markierte Natrium-Ionen enthielt. Normales Natrium hat 11 Protonen und 12 Neutronen und somit die Atommasse 23 u, was man dann als 23Na schreibt. Das im Versuch verwendete radioaktive Natrium hat 11 Protonen und 13 Neutronen, besitzt also eine Atommasse von 24 u, dieses Natrium wird dann als 24Na bezeichnet, und die entsprechenden Natrium-Ionen sind dann die 24Na+-Ionen.
Im Laufe der Zeit dringen viele dieser radioaktiv markierten 24Na+-Ionen in die Nervenzelle ein, die intrazelluläre Konzentration dieses Ions erhöht sich also.
Nun nimmt man die Nervenzelle aus der Lösung mit den radioaktiven Natrium-Ionen heraus und legt sie in normales Salzwasser, das nur 23Na+-Ionen enthält, die nicht radioaktiv sind. Zu diesem Zeitpunkt startet der eigentliche Versuch, wie er in der Abbildung 1 dargestellt ist. Alles andere war quasi nur die Vorbereitung dieses Versuchs.
Da sich im Außenmedium kein radioaktives 24Na+ befindet, im Zellinnern jedoch recht viel, kann man sagen, dass ein 24Na+-Konzentrationsgradient von innen nach außen besteht. Man sollte also erwarten, dass die radioaktiven Natrium-Ionen von selbst passiv nach außen strömen, um einen Konzentrationsausgleich zu erreichen.
Nach ungefähr 100 Minuten gibt man das Zellgift Dinitrophenol (DNP) in das Außenmedium. DNP blockiert die ATP-Synthese.
Für Experten
Die ATP-Synthese beruht ja auf einem Protonengradienten, der sich quer über die innere Membran der Mitochondrien gebildet hat. Durch das passive Zurückströmen der Protonen, was ja ein exothermer Vorgang ist, kann gleichzeitig ATP aus ADP und Phosphat gebildet werden. Das DNP setzt sich aber in die innere Mitochondrienmembran und wirkt dort wie ein Kanalprotein, das Protonen passieren lässt. Die Protonen strömen dann in den Innenraum des Mitochondriums, ohne aber dabei ATP herzustellen. Dabei wird der Konzentrationsgradient der Protonen abgebaut, und die ATPasen, die an sich für die ATP-Herstellung zuständig sind, haben nichts mehr zu tun.
Wenn die ATP-Synthese blockiert ist, geht der 24Na+-Ausstrom aus der Nervenzelle sofort stark zurück. Dies ist ein untrüglicher Beweis dafür, dass kein passiver Transport der 24Na+-Ionen stattfindet, sondern ein aktiver, ATP-abhängiger Transport. Man hat Kontrollversuche mit anderen Stoffen durchgeführt und dabei festgestellt, dass DNA passive Diffusionsvorgänge durch die Membran überhaupt nicht behindert [1].
Nach ca. 190 Minuten wird das DNP wieder ausgewaschen. Es dauert eine kleine Weile, aber dann steht wieder genügend ATP zur Verfügung, so dass der aktive Heraustransport des radioaktiven 24Na+ wieder aufgenommen werden kann.
Durch Blockierung der ATP-Synthese kann man nachweisen, dass das Austreten von Natrium aus der Nervenzelle ein aktiver Transportvorgang ist, der ATP-abhängig ist. Es handelt sich nicht um eine passive Diffusion.
Nachweis der K+-Abhängigkeit
Kommen wir nun zu einer Modifizierung des Versuchs. Bisher haben wir nur nachgewiesen, dass der Transport von Natrium-Ionen nach außen aktiv unter ATP-Verbrauch erfolgt. Noch nicht nachgewiesen haben wir, dass die Kalium-Ionen einen entscheidenden Einfluss auf den Natrium-Transport haben.
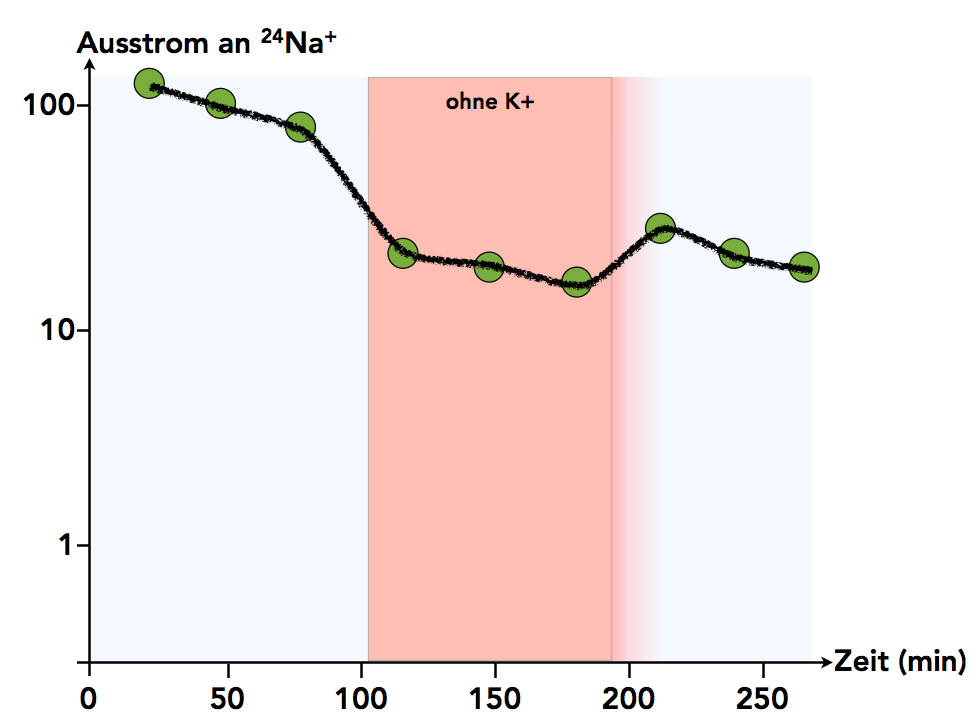
Ein Experiment zum Nachweis der Na+-K+-Pumpe in Anlehnung an eine Darstellung in Schmidt [1].
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Dieser Versuch wurde ähnlich durchgeführt wie der eben beschriebene. Allerdings wurde kein DNP zugegeben, sondern nach einer bestimmten Zeit wurden die Kalium-Ionen aus dem Außenmedium entfernt. Nach einiger Zeit wurde die Nervenzelle wieder in ein Außenmedium mit normaler K+-Konzentration überführt.
Auf den ersten Blick ist der Einfluss der fehlenden Kalium-Ionen nicht so gravierend. Aber man darf sich hier nicht täuschen lassen. Achten Sie auf die senkrechte Achse des Diagramms. Es handelt sich um eine logarithmische Darstellung! Der 24Na+-Ausstrom sinkt von über 100 Einheiten auf ca. 20 bis 30 Einheiten ab, wenn das K+ im Außenmedium fehlt.
Hier kann man ganz deutlich sehen, dass die Natrium-Ionen nur dann aktiv aus der Zelle heraus transportiert werden, wenn genügend Kalium-Ionen im Außenmedium vorhanden sind. Betrachtet man sich die Arbeitsweise der Kalium-Natrium-Pumpe, so ist dies auch verständlich. Fehlen die Kalium-Ionen im Außenmedium, so können die entsprechenden Bindungsstellen im Pumpenprotein nicht besetzt werden, und der Pumpenkreislauf kann sich nicht schließen. Die Pumpe wartet "ewig" auf die beiden Kalium-Ionen und kann daher natürlich keine Natrium-Ionen von innen nach außen transportieren.
Der Transport von Natrium-Ionen aus der Zelle heraus ist nicht nur ein ATP-abhängiger aktiver Transport, sondern er kann nur dann funktionieren, wenn im Außenmedium genügend Kalium-Ionen zur Verfügung stehen. Es handelt sich also um einen typischen Gegentransport.
Quellen:
- Schmidt, Grundriß der Neurophysiologie, Berlin Heidelberg 1987
- Kandel, Schwartz, Jessel, Neurowissenschaften, Heidelberg, Berlin, Oxford 1996.
- Kandel, Schwartz, Jessel, Siegelbaum, Hudspeth, Principles of Neural Science, Fifth Edition. McGraw-Hill Education 2013.
- Alberts et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.