Keratin ist ein wichtiges Faserprotein bzw. Skleroprotein. Allerdings wird mit dem Begriff "Keratin" kein einzelnes Protein mit einer bestimmten Aminosäuresequenz angesprochen, sondern eine ganze Gruppe verschiedener wasserunlöslicher Faserproteine, die nur von Tieren gebildet werden. Die Keratine, die in Säugetieren in Haaren, Hörnern, Nägeln, Klauen etc. vorkommen bezeichnet man als α-Keratine, die Keratine in Spinnen (Spinnenseide), Insekten, Vögeln (Schnäbel, Federn) und Reptilien (Schuppen) als β-Keratine [5].
Der wichtigste Teil des alpha-Keratins besteht aus zwei α-Helices, die sich schraubenförmig umeinanderwinden und so eine Superhelix bilden (engl.: coiled coil). Die beiden Helices werden durch schwache chemische Bindungen (van-der-Waals-Kräfte, ionische Wechselwirkungen), aber auch durch Disulfidbrücken zusammengehalten.
Historisch interessant ist, dass die Sekundärstruktur der α-Helix zum ersten Mal an den Keratinen entdeckt wurde.
Die Keratin-Superhelices sind bis zum Doppelten ihrer Länge dehnbar, wegen der nur schwachen chemischen Bindungen, die die Helices zusammenhalten.
Laut [6] beruht Dehnbarkeit des Keratins "auf einer Umfaltung der α-Helices unter vorübergehendem Aufbrechen von Wasserstoffbrücken zu Faltblattstrukturen mit parallel zueinander ausgerichteten Peptidketten."
Die Disulfidbrücken bleiben bei der Streckung bestehen. Wenn die Zugkraft, die zu der Streckung geführt hat, wieder nachlässt, bilden sich die Helices zurück, sie nehmen ihre ursprüngliche Länge an [1].
Zwei solcher Superhelices lagern sich zu einer Protofibrille zusammen (zumindest beim sogenannten alpha-Keratin). Mehrere Protofibrillen bilden wiederum ein Intermediär-Filament. In normalen Tierzellen bilden diese Intermediär-Filamente dann einen Teil des Cytoskeletts. Inzwischen hat man ca. 20 verschiedene Typen der Keratin-Filamente nachgewiesen [4].
In Haaren, Hörnern, Klauen, Nägeln und ähnlich starren Gebilden lagern sich diese Intermediär-Filamente aber weiter zusammen, nämlich zu Mikrofibrillen, und mehrere Mikrofibrillen bilden dann eine Makrofibrille. Der Durchmesser einer solchen Makrofibrille liegt bei 100 bis 400 nm, während ein menschliches Haar einen Durchmesser von 50 µm hat, also von 50.000 nm. Daher kann man leicht ausrechnen, dass ein Haar aus Tausenden solcher Makrofibrillen zusammengesetzt ist [4]. Der Keratin-Anteil eines menschlichen Haars liegt bei 80% [5].
Ein ähnliches Baumuster aus Mikro- und Makrofibrillen finden wir bei mehreren faserförmigen Strukturen im Tier- und Pflanzenreich. Cellulose-Moleküle sind beispielsweise ähnlich organisiert.
Das Keratin-Molekül besteht aber nicht nur aus einer alpha-Helix. An den beiden Enden des Moleküls finden sich Bindungsstellen, mit denen sich die Superhelices mit anderen Superhelices zu langen Filamenten verbinden könnnen [2].
Im Innern einer Epithelzelle (Epithel = Abschlussgewebe, zum Beispiel die äußeren Schichten der Haut) erstrecken sich die Keratin-Filamente von einem Ende der Zelle bis zum anderen Ende und verleihen den Zellen damit eine enorme Zugfestigkeit. Doch damit nicht genug: Über sogenannte Desmosomen nehmen die Keratin-Filamente einer Zelle Kontakt mit den Keratin-Filamenten der Nachbarzellen auf. So ensteht eine übergeordnete sehr stabile Netzwerk-Struktur innerhalb des Abschlussgewebes [2, 6].
Noch eine Sache macht die Keratin-Filamente sehr stabil: Die Bindungsstellen am Ende der Superhelices ragen ein wenig aus den Molekülen heraus. Dadurch können die Superhelices mit anderen Molekülen Kontakt aufnehmen, so dass eine Quervernetzung entsteht.
Die genaue chemische Zusammensetzung des Keratins unterscheidet sich in den einzelnen Geweben eines Organismus und auch von Lebewesen zu Lebewesen. So hat das Keratin in Seide und in Spinnenweben einen hohen Gehalt an Glycin und Alanin, was die Bildung von beta-Faltblättern begünstigt. Dieses Keratin wird daher als beta-Keratin bezeichnet. Das alpha-Keratin in den Hörnern, Klauen, Nägeln und Haaren der Säugetiere dagegen enthält viele Cystein-Bausteine, damit sich viele Disulfidbrücken bilden können, die das Keratin besonders belastbar machen [3]. Das Horn der Nashörner enthält besonders viel Cystein, nämlich 18% nach [3] und [5], nach [6] sogar bis zu 22%. Haut, Haar und Wolle enthalten dagegen nur ca. 10 bis 14% Cystein [6].
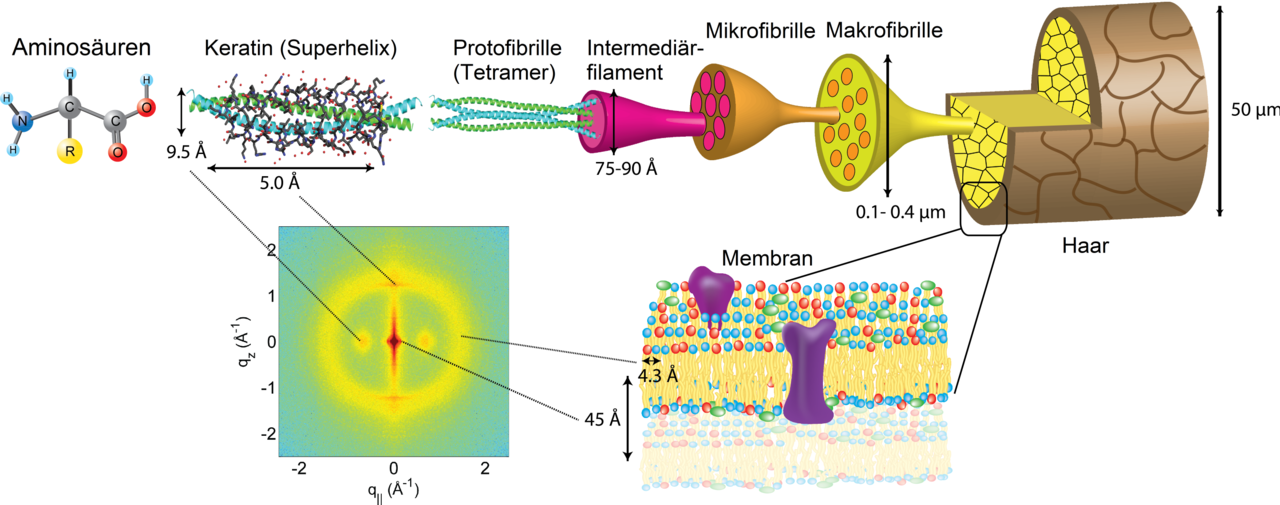
Aufbau eines menschlichen Haars
Yang, Zhang, Rheinstädter, Translation: Chemieja, CC BY-SA 4.0, via Wikimedia Commons
Der unangenehme Geruch beim Verbrennen von Haaren ist vor allem auf das Cystein zurückzuführen, das beim Verbrennen Schwefeldioxid und andere schwefelhaltige Gase bildet.
Quellen:
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Alberts, Bruce et al. Lehrbuch der Molekularen Zellbiologie, 5. Auflage, Weinheim 2021.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Wikipedia, Artikel "Keratine"
- Chemgapedia, Artikel "Das Strukturprotein Keratin"
- Spektrum-Lexikon der Biologie, Artikel "Keratine"