Glucose oder Traubenzuckerist das mengenmäßig häufigste Monosaccharid, das in der Natur vorkommt. Das liegt daran, dass alle Zellwände der Pflanzen aus Cellulose aufgebaut sind, und Cellulose ist ein Makromolekül, das aus vielen Tausend Glucose-Einheiten besteht.
Struktur
Betrachten wir zunächst die Strukturformeln von Glucose und vergleichen Sie mit der Strukturformel von Fructose (Fruchtzucker), einem anderen Monosaccharid mit sechs C-Atomen. Die Strukturformeln werden hier als Fischer-Projektionen dargestellt:
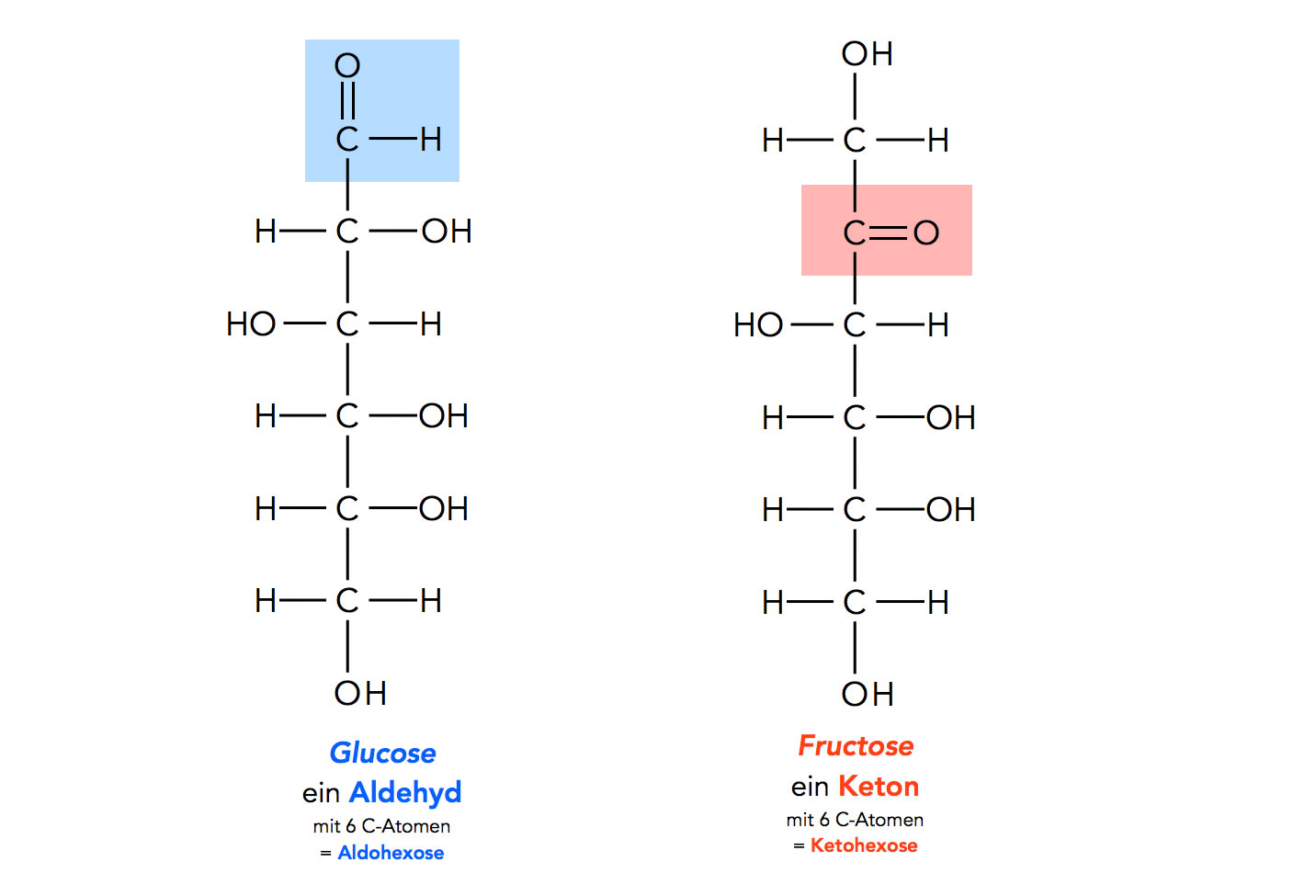
Glucose und Fructose in der Kettenform (Fischer-Projektion)
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Wenn man die vielen OH-Gruppen an den C-Atomen einmal vernachlässigt, könnte man Glucose als ein Hexanal-Derivat, Fructose als ein Hexan-2-on-Derivat bezeichnen. Das spiegelt sich auch in den Bezeichnungen Aldohexose und Ketohexose für Glucose und Fructose wieder. Allerdings gibt es mehrere Aldohexosen und auch mehrere Ketohexosen, Glucose und Fructose sind nur die bekanntesten Vertreter dieser Stoffklassen.
Die korrekte chemische Bezeichnung der Glucose wäre 2,3,4,5,6-Pentahydroxy-hexanal. Dieser Name wird jedoch in der Literatur und im Internet so gut wie nie benutzt, weil er so kompliziert und schlecht zu merken ist. "Glucose" oder "Traubenzucker" sind die gängigen Bezeichnungen für dieses Monosaccharid, auch in der Fachliteratur.
Hier ein schöner Chemiker-Witz:
Kommt ein Chemiker in die Drogerie. Sagt: "Ich hätte gern 250 Gramm 2,3,4,5,6-Pentahydroxy-hexanal". Sagt der Apotheker: "Was ist das denn? Ham wir nicht! Oder meinen Sie vielleicht Traubenzucker?". Sagt der Chemiker: "Ach ja, 'Traubenzucker'. Ich kann mir diese komischen Namen nie merken!".
Ringbildung
In der oben gezeigten kettenförmigen Struktur kommt Glucose in der Natur so gut wie nicht vor. Glucose-Moleküle und auch die Moleküle anderer Pentosen und Hexosen (Monosaccharide mit fünf oder sechs C-Atomen) neigen zur Ringbildung.
Wie kommt diese Ringbildung der Glucose zustande?
Betrachten wir dazu das folgende Bild:

Ringbildung bei der Glucose
Autor: Ulrich Helmich, Lizenz: Public domain.
Die OH-Gruppe am 5. C-Atom der Glucose-Kette reagiert mit der C=O-Gruppe an Position 1. Chemisch gesehen handelt es sich bei dieser Reaktion um eine nucleophile Addition, genauer um eine Halbacetal-Bildung. Auf der Seite über Monosaccharide wird näher auf diese Reaktion eingegangen.
Diese Seite aus dem regulären Chemiekurs behandelt die Addition von Alkoholen an Aldehyde und Ketone und somit die Bildung von Halbacetalen.
Auf dieser Seite wird auf die Stereochemie der Monosaccharide ausführlich eingegangen, auch auf die Chemie der Ringbildung.
Durch die Ringbildung können zwei verschiedene Glucose-Ringe entstehen. Bei der α-Glucose "schaut" die OH-Gruppe am C1-Atom nach "unten", während sie bei der β-Glucose nach "oben" gerichtet ist.
Dieser Unterschied mag klein erscheinen, ist aber von großer Bedeutung. Cellulose, das Polysaccharid, das einen Großteil der Pflanzenzellwände ausmacht, besteht ausschließlich aus β-Glucose-Monomeren. Speicherpolysaccharide wie Stärke (bei Pflanzen) oder Glycogen (bei Tieren) bestehen dagegen ausschließlich aus α-Glucose-Einheiten.
Stereochemie der Glucose
Die kettenförmigen Aldohexosen haben je vier chirale C-Atome, nämlich C2, C3, C4 und C5, daher gibt es 24 = 16 Stereoisomere. Die Isomere, bei denen die OH-Gruppe am C5-Atom in der Kettendarstellung (Fischer-Projektion) nach rechts schaut, werden als D-Isomere bezeichnet. Wenn die C5-OH-Gruppe dagegen nach links gerichtet ist, spricht man von L-Isomeren. In der Natur kommen so gut wie nur die D-Isomere vor. Wenn also von Glucose die Rede ist, ist stets die D-Glucose gemeint, so wie sie im Bild 2 zu sehen ist.
D-Isomere und L-Isomere der Aldohexosen verhalten sich wie Bild und Spiegelbild, es sind also Enantiomere. Die verschiedenen D-Isomere sind dagegen Diastereomere, also Stereo-Isomere, die sich nicht wie Bild und Spiegelbild verhalten. Weitere Einzelheiten dazu finden Sie auf der Seite über Monosaccharide in meinem Chemie-Lexikon.
Wenn sich das Glucose-Molekül zu einem Ring schließt, entsteht ein neues Chiralitätszentrum am C1-Atom. Entsprechend gibt es zwei neue Stereo-Isomere, die sich nicht wie Bild und Spiegelbild verhalten. Bei Kohlenhydraten spricht man jetzt aber nicht von Diastereomeren, sondern von Anomeren. Die α- und die β-Glucose sind also Anomere.
Diese Ringschließung ist auch bei den anderen Aldohexosen und Ketohexosen und auch bei den Aldopentosen zu beoachten.
 Chemische Gleichgewichte bei der Glucose in wässriger Lösung
Chemische Gleichgewichte bei der Glucose in wässriger Lösung
Die drei Formen der Glucose - α-Glucose - Glucose in Kettenform - β-Glucose - stehen in einem Gleichgewicht miteinander, wobei die Kettenform mit nur 0,02% vertreten ist, jedenfalls in wässriger Lösung. Die α-Glucose liegt zu 36% vor, die β-Glucose zu 64%. Somit ist die β-Glucose die häufigste Form der Glucose, zumindest in wässriger Lösung. Das liegt daran, dass in dieser Anordnung die OH-Gruppen am 1. und 2. C-Atom maximal weit voneinander entfernt sind, das ist energetisch einfach günstiger.
Mutarotation
Wie hat man die Umwandlung von α-Glucose in β-Glucose entdeckt? Bestimmte Verbindungen drehen polarisiertes Licht um einen bestimmten Winkel, wenn man eine Lösung dieser Verbindungen damit bestrahlt. Stereoisomere wie α-Glucose und β-Glucose können das polarisierte Licht dabei um unterschiedliche Winkel drehen. Die α-Glucose dreht das Licht um +112 Grad, die β-Glucose um +18,7 Grad.
Löst man nun kristalline Glucose in Wasser, so ändert sich der Drehwinkel des polarisierten Lichts langsam, bis er bei 52,7 Grad stehen bleibt, wenn sich das Gleichgewicht zwischen den beiden Anomeren eingestellt hat. Aus diesem Wert kann man nun die Anteile von α-Glucose und β-Glucose in der Lösung berechnen und kommt auf 36% für die α-Glucose und 64% für die β-Glucose.
Diese allmähliche Einstellung des Gleichgewichts durch Umwandlung des einen Anomers in das andere bezeichnet man als Mutarotation. Eigentlich ist mit diesem Begriff das optische Phänomen gemeint, das mit dieser Umwandlung verbunden ist, nämlich die Änderung des Drehwinkels von polarisiertem Licht.
Eigenschaften (Auswahl)
Feste Glucose C6H12O6 ist ein süß schmeckendes weißes Pulver mit einer Dichte von 1,56 g/cm3 und einem Schmelzpunkt von 146 ºC. Glucose ist sehr gut wasserlöslich; bei 20 ºC lösen sich ca. 470 Gramm Glucose in einem Liter Wasser (das wird nur noch von der Fructose übertroffen). Die hohe Wasserlöslichkeit liegt an den vielen OH-Gruppen im Glucose-Molekül. Jede OH-Gruppe kann Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen.
Glucose liegt in fester Form meist als ein Monohydrat vor - kristallisiert also mit einem Wasser-Molekül pro Glucose-Molekül. In wässriger Lösung ist sie dagegen in geringem Umfang offenkettig (0,02%) und liegt überwiegend als α- oder β-Glucose vor, die durch Mutarotation teilweise ineinander übergehen.
Glucose ist ein Baustein der Zweifachzucker Lactose (Milchzucker), Saccharose (Rohr- oder Rübenzucker) und Maltose sowie von Mehrfachzuckern wie Raffinose und Vielfachzuckern wie Stärke und Amylopectin, Glycogen und Cellulose.
Glucose ist das wichtigste Kohlenhydrat im menschlichen Körper. Die Glucose-Konzentration im Blut wird als Blutzuckerspiegel bezeichnet. Das Gehirn benötigt Glucose als Nährstoff; andere Nährstoffe können die Blut-Hirn-Schranke nicht passieren
Glucose ist das direkte Reaktionsprodukt der Photosynthese und kann von der Pflanze zu Fructose, Galactose und anderen Monosacchariden umgebaut werden, außerdem zu Saccharose sowie zu den Polysacchariden Stärke und Cellulose. Diese werden mit der Nahrung von den Tieren und Menschen aufgenommen und dann wieder zu Glucose abgebaut. Die so aufgenommene Glucose gelangt über den Blutkreislauf zu den einzelnen Zellen, wo sie dann in einem recht komplexen Prozess (Glycolyse, Citratzyklus, Atmungskette) in die universelle Energiewährung ATP umgewandelt wird.
Wenn Sie sich für die weiteren Eigenschaften der Glucose interessieren, kann ich Ihnen die entsprechende Wikipedia-Seite nur empfehlen.