Geschichte, Herstellung
Schon lange vor der Herstellung des ersten Fullerens im Jahre 1985 veröffentlichte Harry P. Schultz 1965 einen wissenschaftlichen Artikel, in dem er die Existenz eines kugelförmigen C60H60-Moleküls für möglich hielt [5].
Fünf Jahre später, also 1970, hat der japanische Chemiker Eiji Osawa auf Grundlage von Berechnungen vorhergesagt, dass große kugelförmige Moleküle aus Kohlenstoff-Atomen existieren können, die keine Wasserstoff-Atome enthalten[2]. Dummerweise erschien der entsprechende Artikel nur auf Japanisch, so dass er von westlichen Wissenschaftlern erst ein paar Jahre später gelesen wurde.
1985 wurden dann Fullerene durch Robert F. Curl jr. (USA), Sir Harold W. Kroto (England) und Richard E. Smalley (USA) künstlich hergestellt [6], indem man Graphit mit Hilfe von Laserstrahlen verdampfte[1,2]. 1996 erhielten sie dafür den Nobelpreis für Chemie, während Osawa dabei nicht berücksichtigt wurde [6]. Bei diesem Herstellungsprozess entstanden Hohlkugeln aus 60, 70 und mehr Kohlenstoff-Atomen, die entfernt an Fußbälle erinnern.
Weitere Einzelheiten zum Herstellungsprozess finden sich in der Wikipedia, Artikel "Fullerene - Herstellung".
Struktur
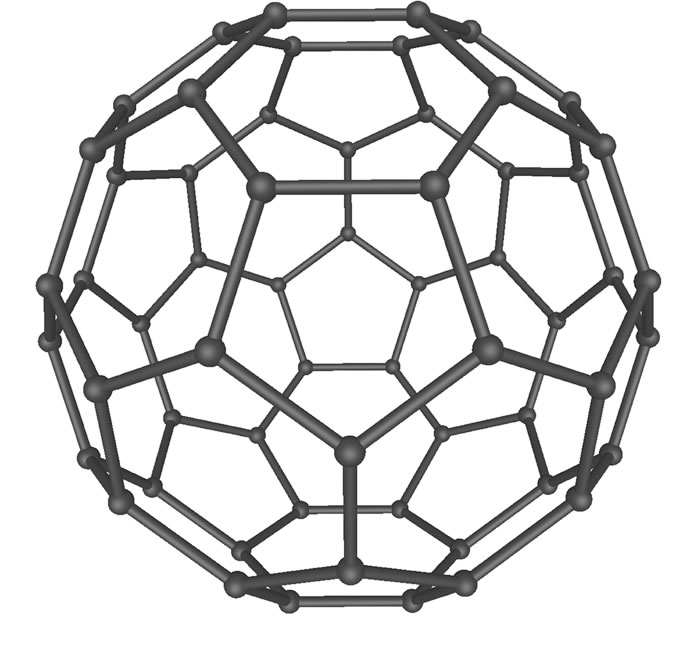
Das C60-Fulleren, aus als "Buckyball" bekannt.
Quelle: Wikipedia, Autor: Mstroeck
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license. Subject to disclaimers.
Das bekannteste und am besten erforschte Fulleren ist das Buckminster-Fulleren aus 60 Kohlenstoff-Atomen, im Englischen auch als "Buckyball" bezeichnet.
Benannt wurde das Buckminster-Fulleren nach dem englischen Architekten Buckminster-Fuller, der 1967 zur Expo in Montreal eine große Kuppel aus sechseckigen und fünfeckigen Zellen konstruiert hatte.

US-Pavillon Biosphère zur Expo 67 von R. Buckminster Fuller
Quelle: Wikipedia, Autor: Cédric Thévenet
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
Das C60-Molekül besteht genau wie ein Fußball aus 20 Sechsecken und 12 Fünfecken, es hat einen Durchmesser von 700 pm. Die C-Atome in den Fullerenen sind wie im Graphit und im Graphen sp2-hybridisiert. Die pz-Orbitale ragen nach innen und nach außen aus der Kugel heraus, so dass die Kugel sowohl auf der Innenseite wie auch auf der Außenseite eine hohe Elektronendichte aufweist.
Während die pi-Elektronen im Graphit delokalisiert sind und eine Elektronenwolke binden, sind sie in den Fullerenen nicht delokalisiert, sondern konzentrieren sich in den Sechsecken [1].
Der Größenvergleich ist interessant - auch für den Chemieunterricht: Würde man das C60-Molekül auf die Größe eines Fußballs vergrößern, dann müsste man einen Fußball auf die Größe der Erdkugel vergrößern [2].
Eigenschaften
Physikalische Eigenschaften
Fullerene sind normalerweise braune bis schwarze Pulver, die leicht metallisch glänzen. An der Luft zerfallen sie schnell zu Graphit. Sie können aber auch als Mineral Fullerit vorkommen (C60). Dieses Mineral hat dann eine Dichte von 1,9 bis 2,0 g/cm3 und eine Härte von 3,5, ist also deutlich härter als Graphit [3].
Während Graphit und Diamant in so gut wie keinem Lösungsmittel löslich sind, lassen sich Fullerene in organischen Lösemitteln auflösen, oft mit markanter Farbe. Das C60-Fulleren löst sich beispielsweise in Toluol mit weinroter Farbe [2].
Bei ca. 400 ºC lassen sich Fullerene sublimieren [6].
Chemische Eigenschaften
Chemisch zeichnen sich Fullerene durch die hohe Reaktivität der C–C-Bindungen nach außen aus, was auf die pz-Orbitale der sp2-hybridisierten C-Atome zurückzuführen ist [4]. Daher können Fullerene leicht Atome oder Moleküle auf der Außenseite binden. Im Grunde handelt es sich dabei um elektrophile Additionsreaktionen.
Aus diesem Grund diskutiert man auch die Möglichkeit, Fullerene als Radikalfänger einzusetzen, welche die Alterungsprozesse in den menschlichen Zellen bremsen sollen. Hierfür gibt es aber noch keine wissenschaftlichen Belege [6].
Kovalente Bindungen ins Innere eines Fullerens sind noch nicht nachgewiesen worden, es gibt aber sogenannte Einschlußverbindungen [4], das heißt, Atome oder Moleküle können in ein Fulleren wie in einen Käfig eingeschlossen werden. Diese Möglichkeit führt dann zu interessanten Anwendungen, in denen man Fullerene als Transportmittel für andere Verbindungen benutzt.
Eine dritte Möglichkeit, chemische Reaktionen mit Fullerenen durchzuführen, ist die Substitution von C-Atomen durch andere Atome. So konnte man beispielsweise die Verbindung C59N herstellen, bei der ein C-Atom durch ein N-Atom ersetzt wurde [6].
Vorkommen
Zunächst konnten Fullerene nur künstlich hergestellt werden, die Vorgehensweisen dazu waren teils recht komplex. Die Synthese von C60 erfolgte beispielsweise in 12 Einzelschritten [1]. Inzwischen hat man aber auch natürliche Vorkommen von Fullerenen entdeckt.
2010 hat man auch im Weltraum Fullerene entdeckt, und inzwischen gibt es sogar eine Theorie, nach der der gesamte Kohlenstoff durch Fullerene aus dem Weltraum auf die Erde gelangt ist [4].
Verwendung
So richtig hat man bisher noch keine bedeutenden Anwendungen für Fullerene gefunden.
Theoretisch könnte man sie in der Medizin als Carrier einsetzen, um bestimmte Medikamente im Körper zu transportieren, denn man kann leicht abbaubare Verbindungen in Fulleren-Käfige einschließen und so vor den Enzymen und dem Immunsystem des Körpers schützen. Allerdings wären die Kosten für solche Verfahren sehr hoch [4]. Auch in der Krebsforschung wird mit den Käfig-Molekülen experimentiert. Fullerene können chemisch so modifiziert werden, dass sie von Krebszellen aufgenommen werden. Dort könnten sie dann bestimmte Medikamente anliefern oder chemische Reaktionen auslösen, welche die Zellen zerstören [7].
Für organische Solarzellen hat man bereits Fullerene eingesetzt, allerdings noch nicht in großem Maßstab [6].
Quellen:
- Riedel, Jannik, Anorganische Chemie, Berlin 2007, S. 512ff.
- Fullerene - Materialinfo, auf www.nanopartikel.info, aufgerufen am 19. Mai 2020.
- Fulleren, auf www.mineralienatlas.de
- Fullerene, im Lexikon der Biologie des Spektrum-Verlags.
- Topological Organic Chemistry. Polyhedranes and Prismanes. Von Harry P. Schultz 1965 im J. Org. Chem. veröffentlicht.
- Fullerene, deutsche Wikipedia, abgerufen am 19. Mai 2020
- Fullerene - Tumor reserch, englische Wikipedia, abgerufen am 19. Mai 2020