Struktur
Graphit ist eine Modifikation (Erscheinungsform) des Elementes Kohlenstoff, die in der Natur neben Diamant, einer anderen Kohlenstoff-Modifikation, vorkommt.
Graphit kristallisiert in einer sogenannten Schichtenstruktur. Innerhalb einer jeden Schicht sind die Kohlenstoff-Atome zu Sechsecken angeordnet - ähnlich wie in Bienenwaben. Jedes C-Atom ist mit drei anderen C-Atomen kovalent verbunden. Allerdings liegen die einzelnen Schichten nicht genau übereinander, sie sind nach einem A-B-A-B-Muster gegeneinander verschoben. Die erste Schicht, die dritte, die fünfte und so weiter sind deckungsgleich, entsprechend die zweite, die vierte, die sechste und so weiter.
Erklärung für die Sekundarstufe 1 und die Stufen EF und Q1:
Für diese kovalenten Bindungen werden drei der vier Außenelektronen des C-Atoms "verbraucht". Das vierte Außenelektron ist an diesen Bindungen nicht beteiligt. Diese Elektronen "schwirren" als freie Elektronen zwischen den C-Atomen innerhalb der Graphitschicht umher und lassen sich durch angelegte elektrische Spannungen leicht verschieben. Dies erklärt die hohe elektrische Leitfähigkeit von Graphit. Oft werden diese freien Elektronen wegen ihres Verhaltens auch als Elektronengas bezeichnet.
Zwischen den Schichten herrschen nur schwache zwischenmolekulare Kräfte, daher lassen sich die Schichten leicht gegeneinander verschieben, was man sich im Alltag beispielsweise beim Schreiben mit einem Bleistift zunutze macht. Übrigens kommt der Name "Graphit" auch daher, griechisch "graphein" heißt nämlich "schreiben".
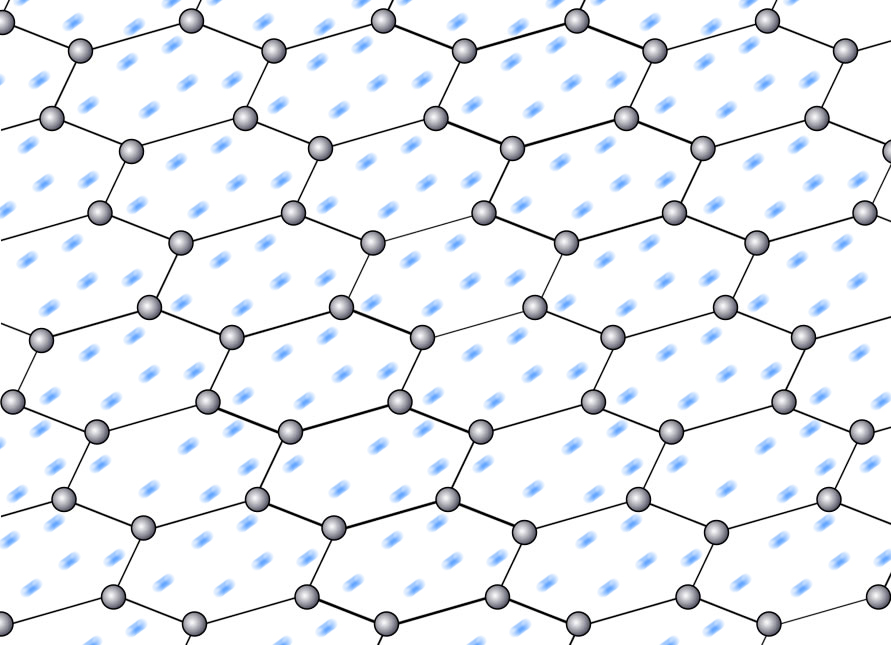
Eine der vielen Schichten des Graphit-Kristalls, perspektivisch dargestellt. Die "vierten" Elektronen sind blau und verschwommen dargestellt, weil sie sich innerhalb der Schicht bewegen können.
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Erklärungen für die Stufe Q2 und darüber hinaus
Alle C-Atome des Graphits liegen in sp2-hybridisierter Form vor. Die pz-Orbitale der C-Atome innerhalb einer Graphitschicht überlappen sich daher, und es bildet sich - ähnlich wie in einem Metall - ein Elektronengas, das sich in einem elektrischen Feld sehr leicht bewegen lässt. Daher hat Graphit eine recht hohe elektrische Leitfähigkeit, weil alle Elektronen der pz-Orbitale über die gesamte Graphitschicht delokalisiert sind.
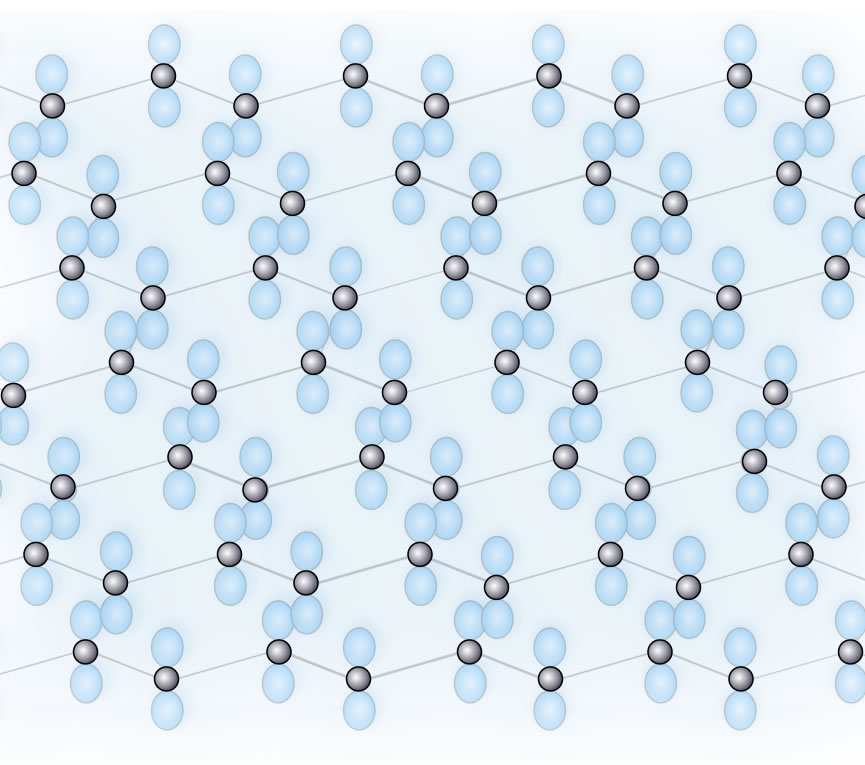
Eine einzelne Graphitschicht mit den pz-Orbitalen
Autor: Ulrich Helmich 2019/2024, Lizenz: Public domain
Die pz-Orbitale der übereinander liegenden Graphitschichten dagegen überlappen nur sehr schwach.
Der C-C-Abstand innerhalb einer Schicht beträgt 246 pm, während der Abstand zwischen zwei deckungsgleichen Schichten 670 nm beträgt. Daher ist die chemische Bindung zwischen den Schichten nicht besonders stark; im Grunde herrschen zwischen den Schichten nur London-Kräfte. Die Graphitschichten lassen sich daher leicht gegeneinander verschieben.
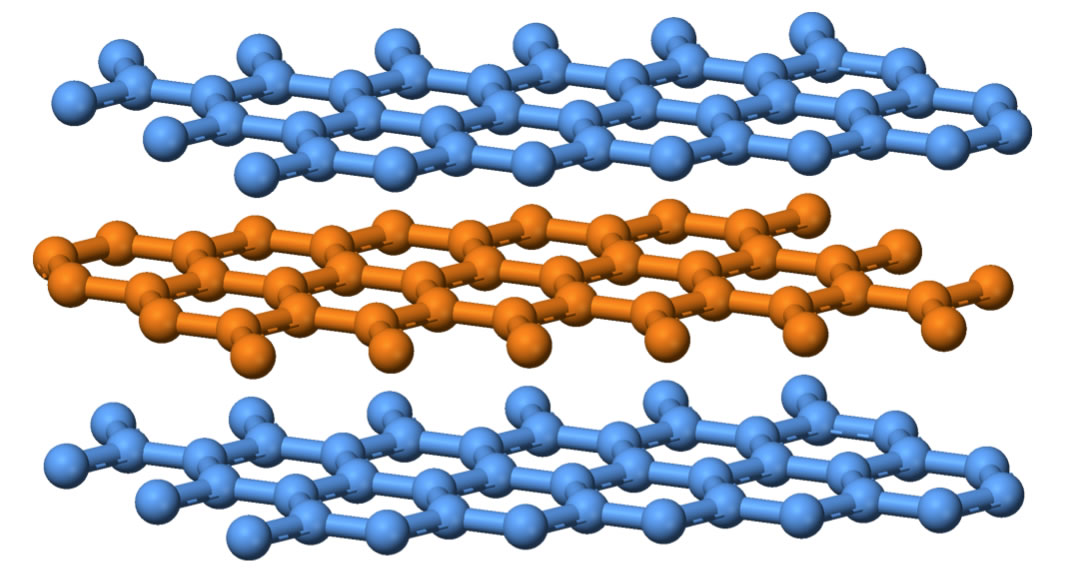
Drei Schichten eines Graphit-Kristalls. Die Schichten sind nach dem A-B-A-B-Muster gegeneinander versetzt.
Quelle: engl. Wikipedia, Autor: Benjah-bmm27, Lizenz: Public domain.
Eigenschaften
Graphit ist ein grauschwarzes bis schwarzes, sehr weiches Nichtmetall, das aber teilweise metallisch glänzen kann. Seine Dichte beträgt im reinsten Zustand 2,265 [1], im "Normalzustand" liegt die Dichte zwischen 2,1 und 2,3.
Normalerweise denkt man bei Graphit an Kohle. Jedoch ist Graphit - im Gegensatz zu Kohle - gar nicht so leicht brennbar [1]. Einen Schmelzpunkt hat Graphit nicht, aber bei ca. 3750 ºC sublimiert er [1].
Ein sehr charakteristisches Merkmal von Graphit ist seine geringe Härte. Bei Berührung fühlt er sich weich und fettig an [1]. Graphit kann daher auch als Schmiermittel in der Industrie eingesetzt werden.
Graphit zeichnet sich durch eine hohe Lichtabsorption aus, er erscheint daher meistens schwarz. Ursache für diese hohe Absorption sind die freien Elektronen, die sehr leicht auf ein höheres Energieniveau angehoben werden können.
Weil die C-Atome untereinander durch kovalente Bindungen sehr fest verbunden sind, ist Graphik in fast allen Lösemitteln unlöslich, sowohl in organischen wie auch in anorganischen.
Verwendung
In der Schule wird Graphit vor allem als Elektrodenmaterial für Elektrolysen verwendet. In der Industrie setzt man Graphit als Schmiermittel und als Elektrodenmaterial für Lichtbogenöfen ein, aber auch für Schmelzflusselektrolysen bei der Metallherstellung [1].
Die Wikipedia [2] listet eine ganze Reihe von Verwendungsmöglichkeiten des Graphits auf, von denen hier nur einige genannt werden sollen:
- Bleistiftminen
- Festschmierstoff
- Gießformen (Auskleidung)
- Ofenauskleidungen
- Elektroden für Metallherstellung
Natürliche Formen des Graphits
Die natürlichen Formen des Graphits sind Koks, Ruß und Holzkohle [3]. Alle drei Formen bestehen aus verunreinigtem Graphit.
Ruß ist ein schwarzes pulverförmiges Material, das oft bei der Verbrennung organischer Verbindungen entsteht, vor allem, wenn diese einen hohen Kohlenstoff-Anteil aufweisen. Benzol und Toluol beispielsweise verbrennen mit stark rußender Flamme, während Ethanol mit blauer Flamme verbrennt und so gut wie nicht rußt.
Der Kohlenstoff-Anteil von Benzol lässt sich aus der Summenformel C6H6 leicht berechnen. Die molare Masse liegt bei 78 g/mol, der Kohlenstoff hat daran einen Anteil von 72 g/mol, das sind 92%. Ethanol mit der Summenformel C2H5OH hat eine molare Masse von 46 g/mol, der Anteil des Kohlenstoffs beläuft sich aber auf nur 24 g/mol, das sind 52%.
Weitere Informationen zu Ruß finden Sie auf der ausführlichen Seite "Ruß" des Energie-Lexikons.
Koks ist ein poröser Brennstoff mit einer großen Oberfläche. Er wird aus Kohle durch Erhitzen unter Sauerstoffabschluss erzeugt [4]. Dieser Vorgang wird als Verkokung bezeichnet.
Weitere Informationen zum Koks entnehmen Sie bitte dem Wikipedia-Artikel "Koks".
Holzkohle ist noch wesentlich poröser als Koks. Sie entsteht beim Verbrennen von trockenem Holz, ebenfalls unter Luftabschluss. Das Holz muss dazu auf ca. 275 ºC erhitzt werden. Dann setzt die Verbrennung des Holzes ein, ein exothermer Prozess, der die Temperatur auf 350 bis 400 ºC steigert [5].
Künstliche Formen des Graphits
Eine wichtige Form des Graphits, die in der Natur nicht vorkommt (im Gegensatz zu Ruß, Koks und Holzkohle, die bei natürlichen Verbrennungsprozessen entstehen können, bei denen es ja auch oft zu Sauerstoffmangel kommt) ist die Aktivkohle.
Aktivkohle ist eine sehr feinkristalline und lockere Form des Graphits, die sich durch eine sehr sehr große Oberfläche auszeichnet. Ein Gramm Aktivkohle hat eine innere Oberfläche von 1000 m2 [3]. Aktivkohle erhält man durch Erhitzen von Holz, tierischen Abfällen oder Rohrzucker. Um eine so große Oberfläche zu erhalten, setzt man der Aktivkohle allerdings Fremdmaterialien bei, zum Beispiel Zinkchlorid. Diese Materialien verhindern ein Zusammenfallen des Kohlenstoffgerüstes beim Erhitzen, und so bleibt die große innere Oberfläche erhalten.
Quellen: