Struktur
Diamant ist eine Kohlenstoff-Modifikation, bei der jedes C-Atom mit vier anderen C-Atomen kovalent verbunden ist. Die C-Atome sind durchweg sp3-hybridisiert, daher betragen die C-C-Bindungswinkel im Diamant 109º.

Diamant, Fundort: Südafrika (Fundort bei mindat.org)
Quelle: Wikipedia, Artikel "Diamant". Autor: Rob Lavinsky, iRocks.com
This file is licensed under the Creative Commons Attribution-Share Alike 3.0 Unported license.
Wenn man jetzt mit einem Molekülbaukasten versucht, ein Diamant-Modell zu bauen, ist das kein Problem, solange man genug C-Atome und Verbindungsstücke hat. An den Außenflächen des Modells gibt es dann allerdings ein Problem: Jedes C-Atom hat dann ja eine ungesättigte freie Bindung.
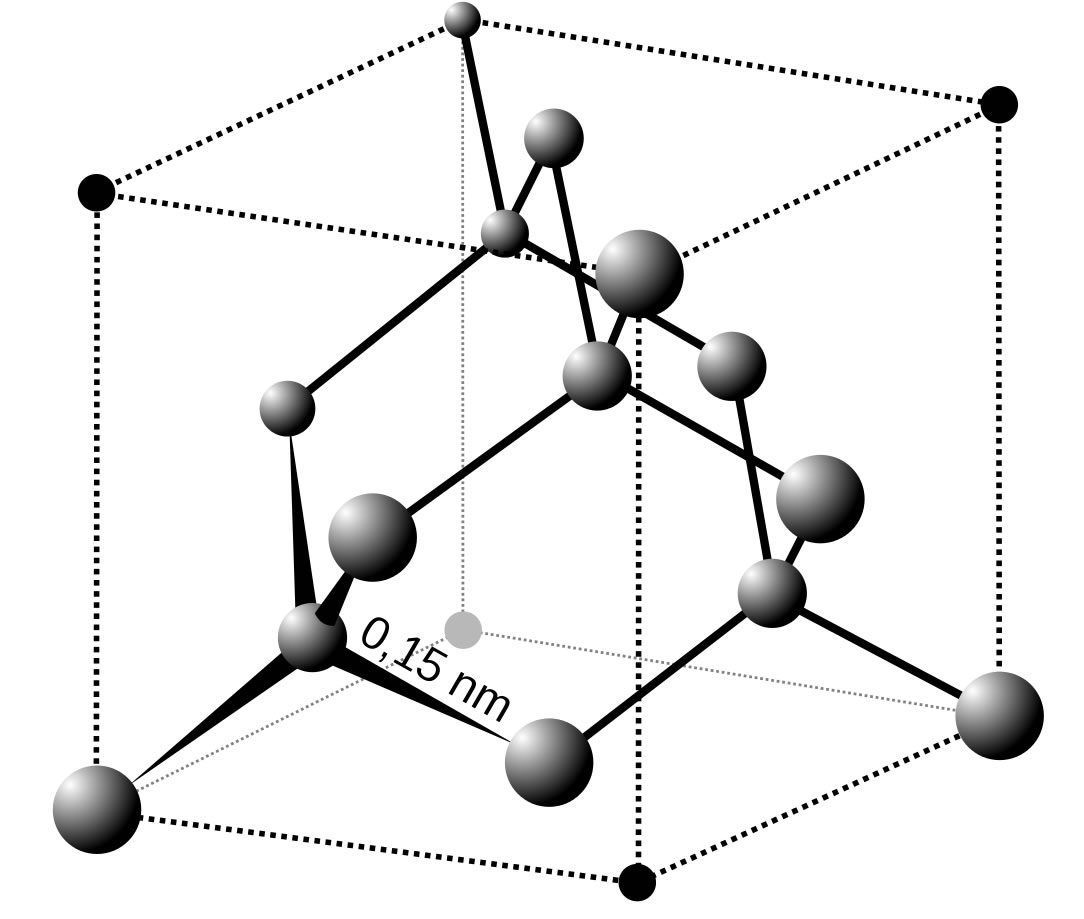
Das Diamantgitter
Quelle: Wikipedia, Artikel "Diamant". Autor: Anton. Vectorized by Magasjukur2
Diese Datei ist unter der Creative-Commons-Lizenz „Namensnennung – Weitergabe unter gleichen Bedingungen 3.0 nicht portiert“ lizenziert.
Eigenschaften
Diamant ist eine der härtesten Substanzen überhaupt und gilt als "härtester natürlicher Stoff" [2]. Auf der Mohs-Skala hat Diamant eine Härte von 10, während die Kohlenstoff-Modifikation Graphit nur eine Härte zwischen 0,5 und 1,0 hat, also sehr weich ist. Darum setzt man Diamanten auch in der Industrie ein, zum Beispiel für Bohrer oder Schleifgeräte. Diamanten haben auch eine sehr hohe Schmelztemperatur, und sie leiten den elektrischen Strom nicht.
Sowohl die enorme Härte wie auch die hohe Schmelztemperatur kann man durch die atomare Struktur des Diamants erklären. Jedes C-Atom ist kovalent mit vier anderen C-Atomen verbunden, und die Bindungsdissziationsenergie der C-C-Einfachbindung ist mit 384 kJ/mol sehr hoch. Alle C-Atome eines Diamanten bilden ein dicht geknüpftes Netzwerk, der ganze Diamant ist quasi ein einziges riesiges Molekül.
Dass Diamanten den elektrischen Strom nicht leiten, kann man ebenfalls auf die atomare Struktur zurückführen. Alle vier Bindungselektronen der C-Atome sind in kovalenten Bindungen lokalisiert. Es gibt keine freien Elektronen, die wie beim Graphit ein Elektronengas bilden könnten.
Die Dichte von Diamant ist mit 3,51 g/cm3 höher als die Dichte von Graphit mit nur 2,25 g/cm3.
Im Prinzip kann man Diamant aus Graphit herstellen. Dazu sind allerdings enorme Drücke (ca. 100.000 atm) und hohe Temperaturen (ca. 3000 ºC) notwendig [3]. Für industrielle Zwecke werden solche künstlichen Diamanten aber bereits seit 1955 hergestellt. Die Hälfte des industriellen Bedarfs wird so gedeckt [4].
Aufgrund der hohen Lichtbrechung, der enormen Härte, des typischen Glanzes und vor allem wegen ihrer Seltenheit sind Diamanten begehrte und sehr teure Edelsteine.
Trotz der Härte können Diamanten relativ leicht in Graphit umgewandelt werden. Dazu sind "nur" Temperaturen von 1500 ºC notwendig [4].
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992, Artikel "Diamant".
- Wikipedia, Artikel "Diamant", abgerufen am 18. Mai 2020.
- T. Brown, H. LeMay, B. Burston, P. Bruice: Chemie für die gymnasiale Oberstufe. München 2013, S. 407.
- Riedel, Jannik, Anorganische Chemie, Berlin 2007, S. 512ff.