 |
 |
 | |
| Brandfördernd | Gas unter Druck | Gesundheitsschädlich |
1. Einführung
Chlormethan ist die einfachste chlorhaltige organische Verbindung überhaupt. Das Gas findet sich in unserer Erdatmosphäre, es wird durch die Industrie, aber auch durch natürliche Quellen freigesetzt. Natürliche Quellen produzieren ca. 4.100.000 t Chlormethan pro Jahr.
"Vertraute Pflanzen wie immergrüne Bäume und Kartoffeln synthetisieren ... Methylchlorid. Es ist dank seiner weit verbreiteten Herstellung in der Natur wie in der Industrie das häufigste chlorhaltige Molekül in der Atmosphäre überhaupt." [8].
2. Strukturdaten
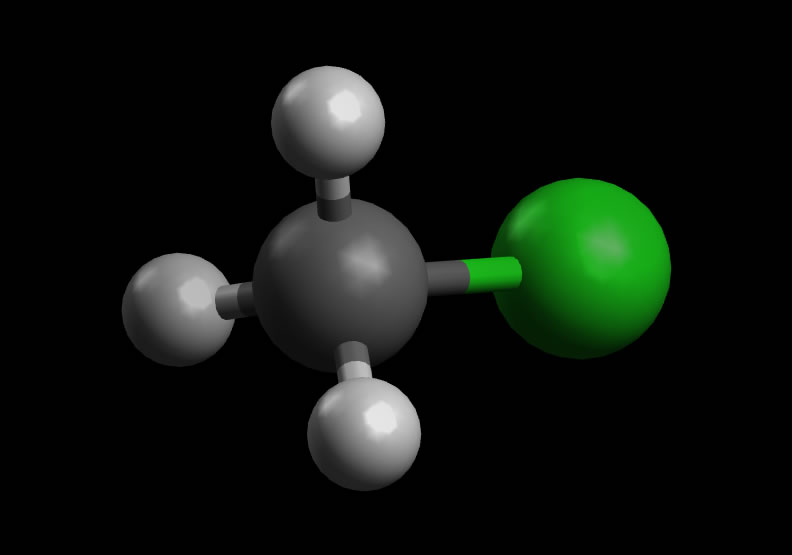
Chlormethan CH3Cl
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die Struktur des Chlormethans sehen wir in der Abb. 1, zu den Strukturdaten (Bindungslängen, Bindungswinkel) liegen mir keine verlässlichen Informationen vor.
Bindungslängen
In einem alten Hochschullehrbuch aus den 80er Jahren habe ich aber eine Tabelle gefunden, laut der die C-Cl-Bindungslänge 179 pm betragen soll, gegenüber den 154 pm einer C-C-Einfachbindung und den 109 pm einer C-H-Bindung.
Bindungswinkel
Über die Bindungswinkel habe ich keine Informationen gefunden, aber es ist davon auszugehen, dass das elektronegative Cl-Atom mit seinen drei freien Elektronenpaaren die 109-Grad-Winkel deutlich verzerrt. Der H-C-H-Winkel sollte deutlich kleiner als 109 Grad sein, der H-C-Cl-Winkel entsprechend deutlich größer.
Bindungsdissoziationsenergie
Die C-Cl-Bindung ist stark polar, wegen des großen EN-Unterschiedes zwischen Kohlenstoff und Chlor (2,2 vs. 3,16 auf der Pauling-Skala der Elektronegativität). Die Bindungsdissoziationsenergie der C-Cl-Bindung beträgt 339 kJ/mol. Zum Vergleich: C-H-Bindung 427 kJ/mol und C-C-Einfachbindung 352 kJ/mol. Die C-Cl-Bindung ist also im Vergleich zur C-H-Bindung deutlich schwächer, daher kann das Cl-Atom relativ "leicht" aus dem Chlormethan-Molekül abgetrennt werden.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedetemperaturen
Chlormethan ist ein farbloses Gas mit einem Siedepunkt von -23,8 ºC und einem Schmelzpunkt von -97,4 ºC. Diese beiden Werte liegen deutlich über denen des Methans, aber auch deutlich unter denen des Methanols.
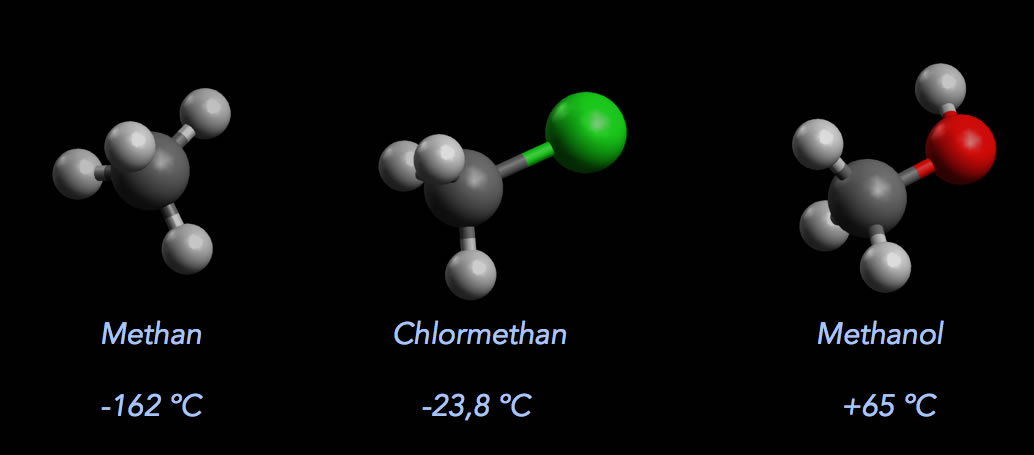
Siedepunkte von Methan (-162 ºC), Chlormethan (-23,8 ºC) und Methanol (+65 ºC)
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Den "mittleren" Siedepunkt von Chlormethan kann man mit Oberstufen-Wissen leicht erklären: Methan-Moleküle ziehen sich lediglich durch schwache London-Kräfte an (in Schulbüchern als "van-der-Waals-Kräfte" bekannt), Methanol-Moleküle aber durch relativ starke Wasserstoffbrücken-Bindungen. Chlormethan-Moleküle sind permanente Dipole, sie können zwar keine H-Brücken untereinander ausbilden, wohl aber "mittelstarke" Keesom-Kräfte (in Schulbüchern als "Dipol-Dipol-Wechselwirkungen" bekannt).
Die van-der-Waals-Wechselwirkung umfassen die Keesom-Wechselwirkungen, die Debye-Wechselwirkungen und die London-Wechselwirkungen. Wer Näheres darüber wissen möchte, geht am besten auf diese Lexikon-Seite.
3.2 Löslichkeitsverhalten
Da Chlormethan-Moleküle keine Wasserstoffbrücken-Bindungen zu Wasser-Molekülen ausbilden können, ist die Wasserlöslichkeit recht gering: In einem Liter Wasser lösen sich maximal 5 g Chlormethan.
3.3 Weitere Daten
Die Dichte eines Gases wird immer in kg/m3 angegeben, sie liegt für Chlormethan bei 2,31 kg/m3 (bei 0 ºC). Zum Vergleich: Die Dichte von Methan beträgt 0,72 kg/m3 (bei 0 ºC). Die hohe Dichte des Chlormethans ist zum einen dem schweren Chlor-Atom geschuldet, zum anderen den stärkeren intermolekularen Anziehungskräften.
4. Gewinnung und Synthese
4.1 Aus Methanol
Chlormethan, ein wichtiges Halogenalkan, wurde zum ersten Mal 1835 von Dumas und Peligot hergestellt, indem sie eine Mischung aus Methanol, Schwefelsäure und Kochsalz erhitzten. Was die Chemiker damals noch nicht wussten: Das Chlormethan wurde durch eine Nucleophile Substitution der OH-Gruppe des Methanols durch Chlor-Atome aus dem Kochsalz synthetisiert. Auch heute noch ist diese Methanolhydrochlorierung die wichtigste Methode zur Herstellung von Chlormethan bzw. Methylchlorid, wie es auch genannt wird.
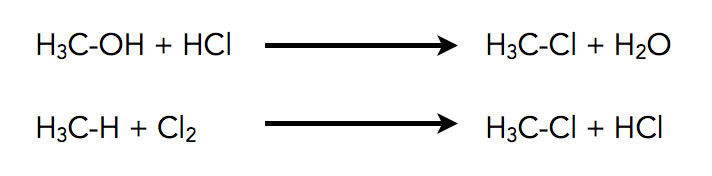
Zwei beliebte Verfahren zur Synthese von Chlormethan
Autor: Ulrich Helmich 2022, Lizenz: ---
4.2 Aus Methan
Eine weniger bedeutsame Methode ist die direkte Chlorierung von Methan bei hohen Temperaturen um 400 bis 500 Grad Celsius. In Chemie-Lehrbüchern und auch im Schulunterricht wird diese Methode aber als Musterbeispiel bzw. Einstiegsbeispiel für die Radikalische Substitution behandelt.
➥Radikalische Substitution
Hier geht es zu den grundlegenden Reaktionstypen, die zur Synthese von Chlormethan benutzt werden können.
5. Reaktionen
5.1 Reaktion mit Wasser
Mit Wasser bildet Chlormethan ein Gashydrat CH3Cl • 6 H2O, das fast wie Schnee aussieht. Die Wasser-Moleküle bilden mit Hilfe von H-Brücken eine Art Käfig, in dem das Chlormethan-Molekül eingeschlossen ist. Allerdings zerfällt dieser Käfig schon bei Temperaturen über 7 ºC.
5.2 Reaktion mit Metallen
Mit Alkali- und Erdalkalimetallen, aber auch mit Aluminium oder Zink kann Chlormethan metallorganische Verbindungen bilden, zum Beispiel CH3-Mg-Cl oder Al(CH3)3 • AlCl3. Chlormethan wird auch zur Herstellung von Tetramethylblei verwendet, einem Benzin-Zusatz, der das Klopfen des Verbrennungsmotors reduziert:
4 CH3Cl + 4 Mg → 4 CH3-Mg-Cl
4 CH3-Mg-Cl + 2 PbCl2 → Pb(CH3)4 + Pb + 4 MgCl2
Wegen der Giftigkeit der Blei-Emissionen, die beim Betreiben des Antiklopfmittels unweigerlich auftreten, ist diese Kraftstoffzusatz heute aber nicht mehr aktuell.
5.3 Nucleophile Substitution
Chlormethan kann wie alle Halogenalkane eine Nucleophile Substitution eingehen, beispielsweise kann das Chlor-Atom durch eine Hydroxygruppe ersetzt werden.
6. Vorkommen, Bedeutung, Verwendung
Ein Großteil (ca. 70%) des industriell hergestellten Chlormethans wird für die Produktion von Silikonen (Kunststoffe auf Silicium-Basis) eingesetzt. Chlormethan wird außerdem bei der Erzeugung von "agricultural chemicals (8%), methyl cellulose (6%), quaternary amines (5%), butyl rubber (3%), and for miscellaneous uses including tetramethyl lead (2%)" eingesetzt [3].
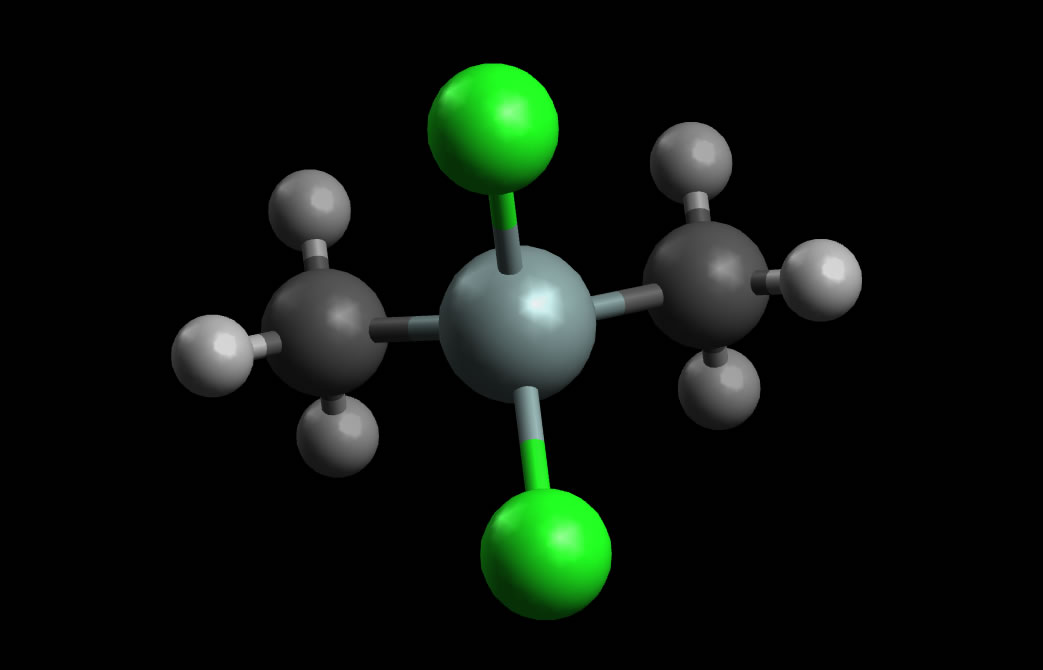
Dichlor-dimethyl-silan
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der Herstellung von Silikonen wird zunächst das Zwischenprodukt Dichlor-dimethyl-silan aus Chlormethan und elementarem Silicium synthetisiert:
Si + 2 CH3Cl → H3C-SiCl2-CH3
Pulverförmiges Silicium reagiert mit Chlormethan bei 350 ºC und in Gegenwart von Kupferpulver und CuCl2 als Katalysator zu Dichlor-dimethyl-silan [4].
7. Versuche
7.1 Experimente aus dem Buch von Just und Hradetzky von 1978 [5].
Die meisten Versuche aus diesem alten DDR-Buch können heute aus Sicherheitsgründen nicht mehr in Schulen durchgeführt werden. Dennoch, der Vollständigkeit halber, möchte ich hier einige Versuche aus diesem Buch zum Thema Chlormethan aufzeigen - allerdings ohne konkrete Versuchsanleitungen. Falls Sie vorhaben, einen dieser Versuche durchzuführen, dann müssen Sie sich die Anleitung selbst besorgen. Das genannte Buch gibt es manchmal bei Ebay zu einem sehr günstigen Preis.
108 Explosion eines Methan-Chlor-Gemischs
109 Verbrennung von Methan in Chlor
110 Reaktion von Methan mit Chlor in zerstreutem Licht
111 Bildung von Monochlormethan
Dieser letzte Versuch scheint mir noch am geeignetsten für einen Demonstrationsversuch in der Schule. In einem Reagenzglas erhitzt man ein Gemisch aus Natriumchlorid, Methanol und konz. Schwefelsäure und leitet das entstehende Chlormethan in die Flamme eines zweiten Brenners. Gefahren- und Sicherheitshinweise findet man in dem Buch noch nicht, und eine Gefährdungsbeurteilung natürlich auch noch nicht - das müssen Sie sich alles selbst besorgen. Bei der Reaktion handelt es sich um eine nucleophile Substitution der OH-Gruppe.
Ich selbst habe einen ähnlichen Versuch - Bildung von Bromethan aus Ethanol und Kaliumbromid - früher immer als Schülerversuch durchführen lassen, und es hat immer gut funktioniert.
7.2 Aus dem Schroedel-Band "Chemie heute SII" von 2009
Reaktivitäts-Unterschiede bei Alkoholen
Bei diesem Versuch wird zwar nicht mit Methanol als Ausgangsstoff gearbeitet, sondern mit den drei Butanol-Isomeren, aber vielleicht funktioniert der Versuch ja auch mit Methanol. Statt Natriumchlorid setzt man hier Zinkchlorid ein, und statt konz. Schwefelsäure wird konz. Salzsäure verwendet. Zu einer gekühlten Mischung aus wasserfreiem Zinkchlorid und konz. HCl fügt man einige Tropfen des Alkohols zu.
Synthese eines Halogenalkans
Auch bei diesem Versuch wird nicht mit Methanol gearbeitet, sondern mit dem tertiären 2-Methylpropan2-ol. Diesmal wird Calciumchlorid und konz. Salzsäure als "Spender" des Chlor-Atoms eingesetzt.
7.3 Aus dem Organikum von 2004
Hier findet man "nur" eine allgemeine Versuchsvorschrift für "die Veresterung von Alkoholen mit Bromwasserstoffsäure". Der Versuch ist sehr aufwändig und mit Sicherheit nicht für die Schule geeignet. Ob er für die Synthese von Chlormethan abgewandelt werden kann, ist fraglich.
Quellen:
- Wikipedia, Artikel "Chlormethan"
- Wikipedia, Artikel "Tetramethylblei"
- "Chlormethane: Production, import/export, use and disposal" auf www.atsdr.cdc.gov.
- Wikipedia, Artikel "Dichlordimethylsilan".
- Just, Hradetzky, Chemische Schulexperimente Band 4, Frankfurt/M. 1978.
- Schroedel, Chemie heute S. II, 2006.
- Organikum, 22. Auflage, Weinheim 2004.
- Gribble: "Umweltgifte vom Gabentisch der Natur". In: Spektrum der Wissenschaft Juni 2005.