Stellung im System der Farbmittel
Der Begriff "Farbmittel" ist nach einer Industrienorm (DIN 55943) die Sammelbezeichnung für alle farbgebenden Stoffe. Zunächst teilt man die Farbmittel in organische und anorganische Farbmittel ein.
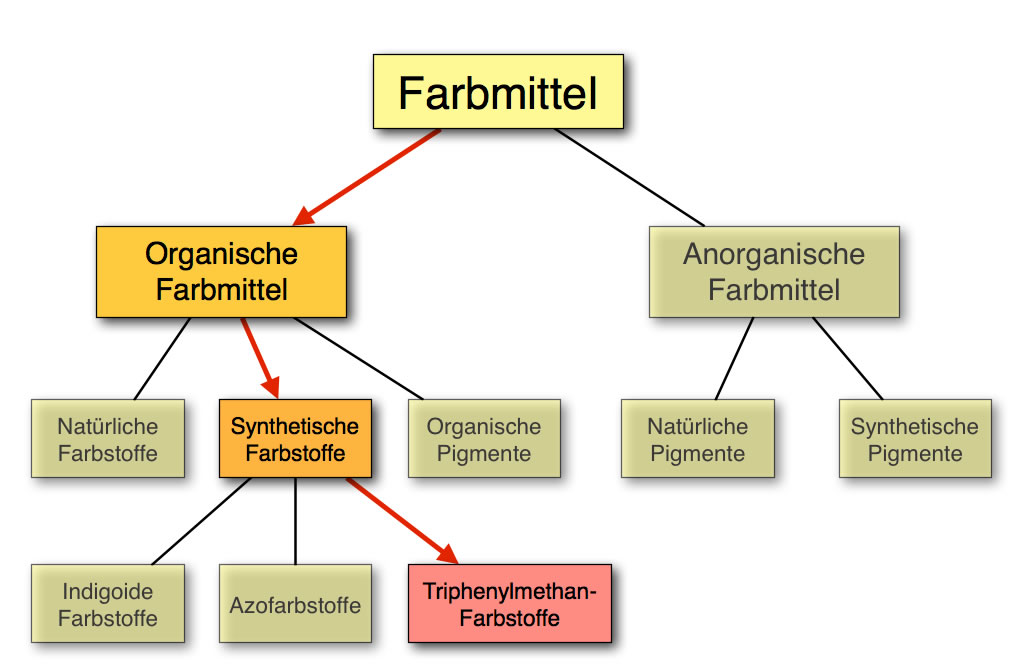
Stellung der Triphenylmethan-Farbstoffe im System der Farbmittel
Die organischen Farbmittel können auf vielfältige Weise unterteilt werden. Meistens unterteilt man die organischen Farbstoffe in natürliche und künstlich hergestellte. Zu den natürlichen Farbstoffen gehören beispielsweise Indigo und Purpur. Die meisten organischen Farbstoffe werden synthetisch hergestellt. Nach dem obigen Schema gibt es drei große Gruppen synthetischer organischer Farbstoffe, in der Wikipedia werden dagegen sechs Gruppen unterschieden. Die Triphenylmethan-Farbstoffe werden aber in allen Unterteilungen als eigenständige Gruppe behandelt. Zu dieser wichtigen Gruppe gehören so bekannte Farbstoffe wie Phenolphthalein oder Fluorescein. Im Schulversuch kann man Triphenylmethan-Farbstoffe recht leicht herstellen, allerdings sind die dabei eingesetzten Chemikalien nicht immer unproblematisch.
Grundstruktur
Das Triphenylmethan ist die Basis aller Triphenylmethan-Farbstoffe.
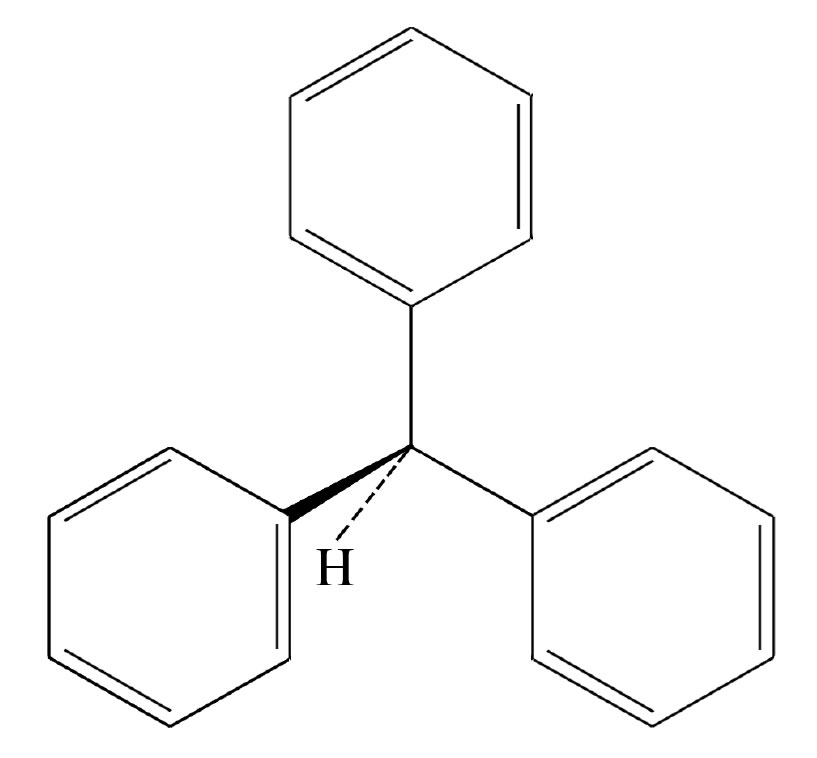
Grundstruktur von Triphenylmethan
Triphenylmethan ist ein farbloser Feststoff. Die Verbindung kann aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung (elektrophile Substitution) hergestellt werden.
Die H-Atome der drei Benzolringe behindern sich gegenseitig, daher sind die drei Ringe propellerartig gegeneinander verdreht, was man in dem Bild allerdings nicht sehen kann.
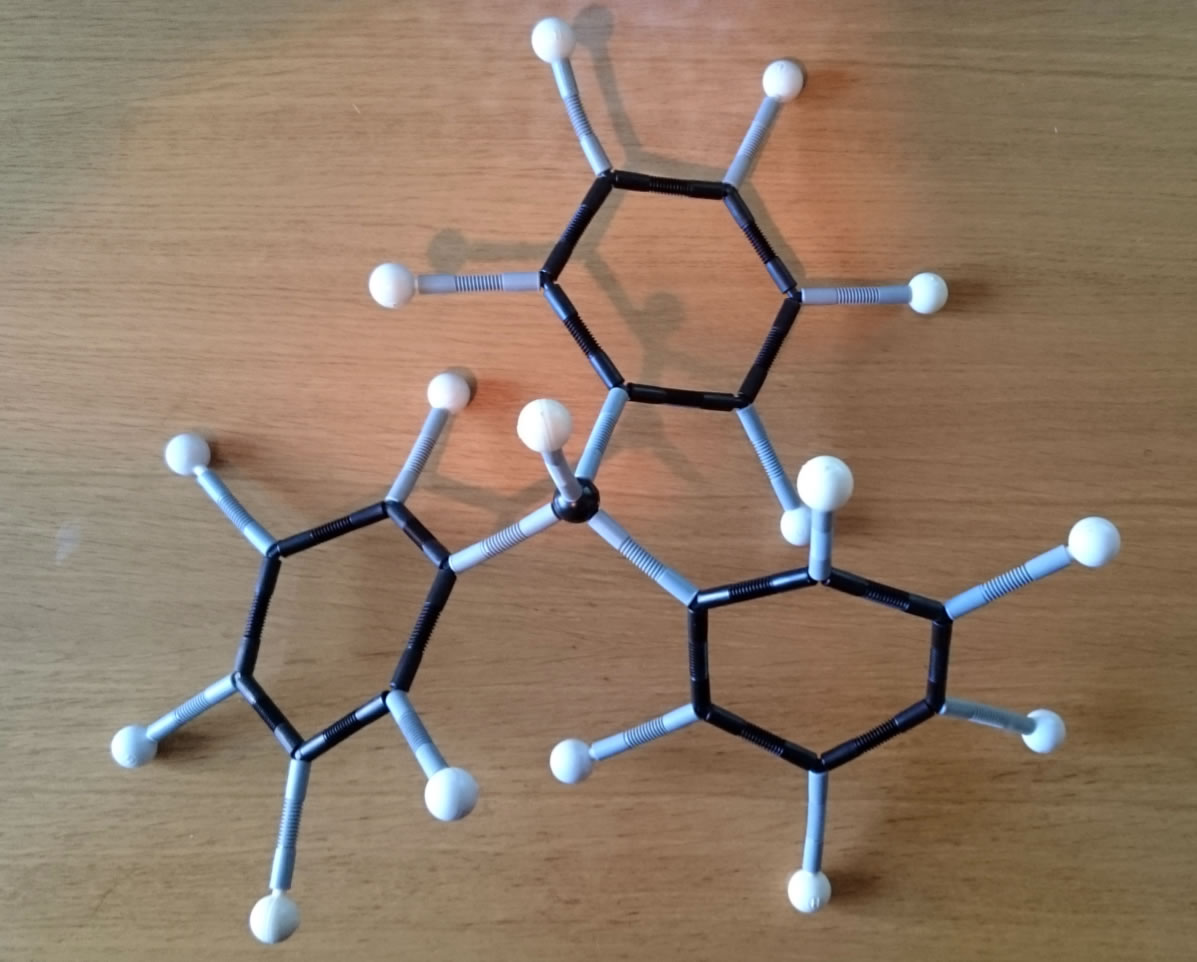
Grundstruktur von Triphenylmethan im Kugel-Stab-Modell
Daher habe ich das Molekül einmal mit einem Molekülbaukasten zusammengebaut und photographiert.
Synthese von Triphenylmethan
Das folgende Schema zeigt die wichtigsten Syntheseschritte der Herstellung von Triphenylmethan aus Benzol und Trichlormethan durch FRIEDL-CRAFTS-Alkylierung.
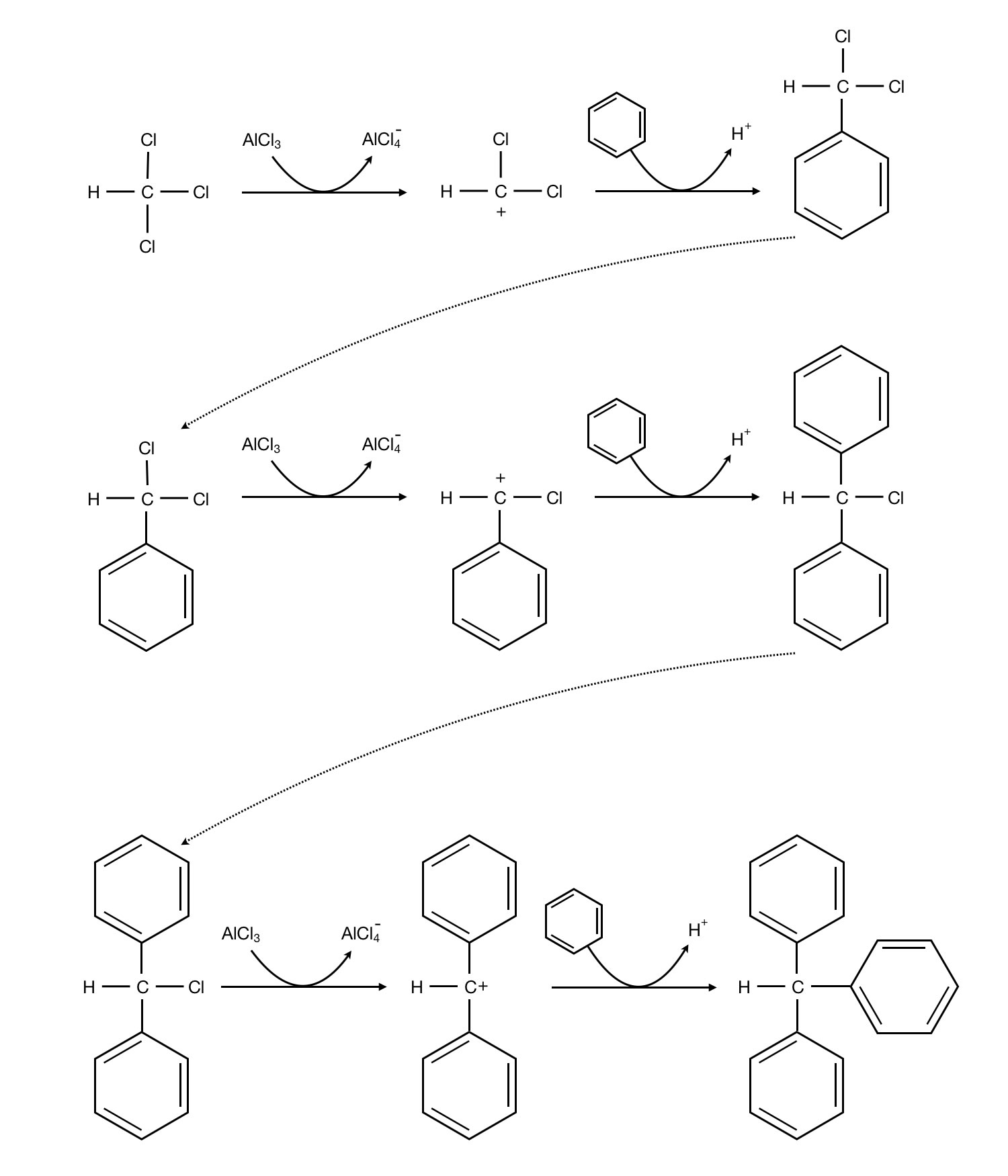
Synthese von Triphenylmethan in drei großen Schritten
Wie man auf dieser Abbildung gut sehen kann, handelt es sich um eine typische FRIEDL-CRAFTS-Alkylierung mit Aluminiumchlorid als Katalysator. Die pi- und sigma-Komplexe sind in dieses Schema nicht eingezeichnet; das Schema ist auch so schon komplex genug.
Allerdings ist diese Synthese rein theoretischer Natur; im Schulversuch bringt sie nichts, weil das Triphenylmethan nämlich ein völlig farbloser Stoff ist.
Farbigkeit von Triphenylmethan und Verwandten
Warum ist Triphenylmethan eine farblose Verbindung? Schaut man sich das Molekül näher an, fällt auf, dass das mittlere C-Atome sp3-hybridisiert ist, es stellt also kein pz-Orbital zur Verfügung. Somit sind die drei Benzolringe des Moleküls voneinander isoliert, Triphenylmethan-Moleküle besitzen drei voneinander räumlich getrennte aromatische Systeme. Die pi-Elektronen sind also immer nur über 6 C-Atome delokalisiert. Die drei pi-Elektronensysteme sind nicht groß genug, um von sichtbarem Licht angeregt werden zu können. Gelänge es aber, das mittlere C-Atom in einen sp2-hybridisierten Zustand zu versetzen, dann könnten alle 19 pz-Orbitale (6 + 6 + 6 + 1) ein zusammenhängendes System bilden, und das resultierende Carbenium-Ion würde sichtbares Licht absorbieren und wäre dann für das menschliche Auge farbig.
Da große delokalisierte pi-Systeme grundsätzlich stabiler sind als kleine delokalisierte pi-Systeme (19 vs. 6 + 6 + 6), sollte man das Triphenylmethan relativ leicht in ein entsprechendes Carbenium-Ion überführen können.
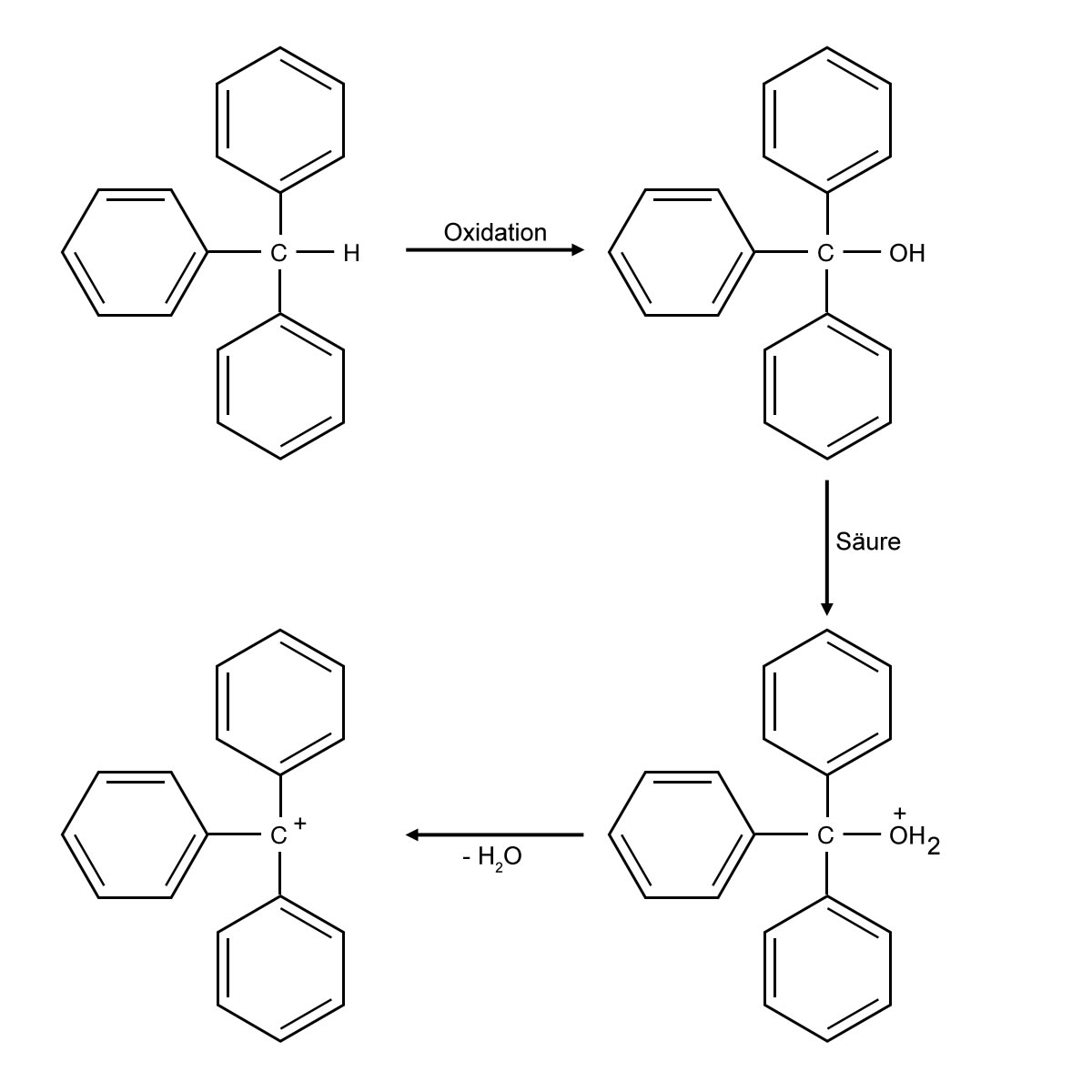
Aus dem Triphenylmethan wird ein Carbenium-Ion
Zunächst wird Triphenylmethan oxidiert, dabei entsteht Triphenylmethanol. Durch Ansäuern lagert sich ein Proton an die $OH$-Gruppe des Alkohols an, und die instabile $OH_{2}^{+}$-Gruppe kann dann leicht als Wasser abgespalten werden. Übrig bleibt das Carbenium-Ion mit einem sp2-hybridisierten zentralen C-Atom. Dieses Kation absorbiert Licht der Wellenlänge 428 nm[1], daher erscheint der Stoff dem menschlichen Auge gelb. Das Carbenium-Ion liegt natürlich nicht in reiner Form vor, sondern bildet zusammen mit den Säurerest-Anionen der zugesetzten Säure ein Salz.
Wie wir auf der Seite "Beeinflussung der Lichtabsorption" bereits gesehen haben, kann man durch Anhängen auxochromer Gruppen eine Verschiebung des Absorptionsmaximums zu längerwelligen Bereichen hin erreichen. Eine solche auxochrome ("farbverstärkende") Gruppe ist beispielsweise die $N(CH_{3})_{2}$-Gruppe. Baut man eine solche Gruppe in das Triphenyl-Kation ein, so erhält man den Farbstoff Fuchsondimethylimmonium bzw. das Salz Fuchsondimethylimmoniumchlorid. Dieser Farbstoff absorbiert Wellenlängen von 480 nm. Durch Einführung einer zweiten $N(CH_{3})_{2}$-Gruppe in einen der beiden anderen Benzolringe erhält man Malachitgrün, das bei 623 nm im roten Bereich absorbiert und daher grün aussieht.
Verbindet man schließlich den dritten Benzolring mit einer weiteren $N(CH_{3})_{2}$-Gruppe, so ergibt das den Farbstoff Kristallviolett, der Licht der Wellenlänge 553 nm absorbiert[2]. Andere Quellen berichten von einem Absorptionsmaximum bei 592 nm[1].
Seitenanfang -
Weiter mit
Fluorescein ...