Das Dalton-Modell der Klasse 7
Im Chemie-Unterricht der Stufe 7 hast du sicherlich das Kugelteilchenmodell von Dalton kennen gelernt. Danach bestehen alle chemischen Elemente aus Atomen, jedes Element aus einer eigenen Atomsorte. Die Atome stellte sich Dalton als feste, winzig kleine und vor allem unteilbare Kugeln vor. Leichte Elemente wie Lithium oder Kohlenstoff bestehen nach Dalton aus kleinen Atomen, schwere Elemente wie Gold oder Blei aus größeren Atomen. Verbindungen bestehen nach Dalton aus Molekülen, und jedes Molekül besteht aus mindestens zwei gleichen oder verschiedenen Atomen. Ein Wasser-Molekül beispielsweise besteht aus einem Sauerstoff-Atom (groß) und zwei Wasserstoff-Atomen (klein).
Grenzen des Dalton-Modells
Das Dalton-Modell kann viele chemische Phänomene gut erklären, wie wir schon auf der Seite "Das Daltonsche Atommodell" gesehen haben. Wir wollen uns nun einen Versuch ansehen, der mit dem Atommodell von Dalton nicht erklärt werden kann.
Versuch
Wir elektrolysieren eine Zinkbromid-Lösung
Durchführung:
Zunächst stellen wir eine Petrischale auf einen Overhead-Projektor, die mit Zinkbromid-Lösung gefüllt ist. Dann stellen wir zwei Kohleelektroden in die Schale, ähnlich wie auf der folgenden Abbildung:
Nun legen wir eine Gleichspannung von ca. 5 bis 10 V an und beobachten über einen längeren Zeitraum, vielleicht 5 bis 10 Minuten.
Beobachtungen:
Bereits nach wenigen Minuten kann man eine intensive Gelbfärbung am Pluspol erkennen, teils sogar einen rotbraunen Farbton. Mit der Zeit breitet sich diese Färbung über die ganze Petrischale aus, bis die Flüssigkeit schließlich einheitlich rotbraun gefärbt ist.
An dem Minuspol bildet sich eine feste graue Substanz. Wenn wir den Versuch richtig durchführen (die Spannung darf nicht zu hoch sein), entsteht ein regelrechter "Baum".
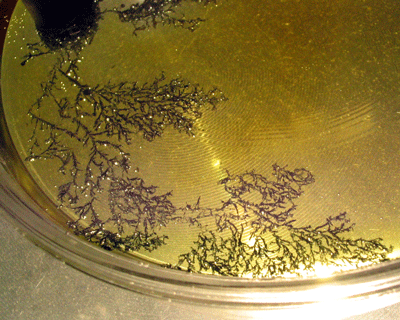
Der Baum am Minuspol wächst eindrucksvoll, wenn die Spannung nicht zu hoch ist und man lange genug wartet.
Neben dieser eindrucksvollen Baumbildung und der Färbung kann man noch zwei weitere Beobachtungen machen: am Pluspol steigt ein farbloses Gas nach oben, und es riecht während des Versuchs nach Schwimmbad.
Dalton hätte den Versuch gar nicht erklären können!
Wie hätte Dalton diesen schönen Versuch erklärt. Dass sich die Verbindung Zinkbromid ZnBr in die beiden Elemente Zink Zn und Brom Br zerlegen lässt, könnte Dalton noch gut erklären. Zinkbromid besteht als Verbindung aus Zink-Atomen und Brom-Atomen. Bei dem Versuch trennen sich nun diese Atome, und so entstehen die Elemente Zink und Brom.
Trotzdem können wir den Versuch mit dem Daltonschen Atommodell nicht vollständig erklären. Warum bildet sich der Zinkbaum am Minuspol, und wieso bildet sich das Brom am Pluspol?
Der Minuspol zieht grundsätzlich nur positiv geladene Teilchen an, und der Pluspol zieht ausschließlich negativ geladene Teilchen an. Nach Dalton sind Atome aber nicht geladen, sondern elektrisch neutral. Zink- und Brom-Atome könnten nach Dalton also gar nicht vom Minus- bzw. vom Pluspol angezogen werden.
Die einzige logische Schlussfolgerung: Zink-Atome müssen bei diesem Versuch positiv geladen sein (werden vom Minuspol angezogen), und Brom-Atome müssen negativ sein (werden vom Pluspol angezogen). Das Dalton-Modell hat aber keine Erklärung für die Existenz elektrisch geladener Atome.
Tausend Dank an Herrn F. Jungkamp, der einen gravierenden Fehler in dieser fettgedruckten Zusammenfassung gefunden hat! Peinlich, peinlich..., offensichtlich leide ich nicht nur an einer Rechts/Links-Legasthenie, die mir fast den Führerschein gekostet hätte, sondern auch an einer positiv/negativ-Schwäche.
Das Dalton-Modell muss erweitert werden!
Wenn man einerseits ein gutes Atommodell hat, mit dem man viele Phänomene erklären kann, und andererseits ein Phänomen auftaucht, das man mit dem Atommodell nicht erklären kann, dann hat man kein Problem, sondern eine Chance. Nämlich die Chance, das bisherige Atommodell zu verbessern.
Das Modell von Dalton muss also so verbessert werden, dass die Existenz von positiv geladenen Zink-Atomen und von negativ geladenen Brom-Atomen erklärt werden kann.
Schauen wir uns die Aussagen dieses Modells noch einmal an:
Das Daltonsche Atommodell
- Atome bestehen aus kleinen, massiven, unteilbaren Kugeln.
- Jedes Element besteht aus einer eigenen Atomsorte. Es gibt also genau so viele Atomsorten, wie es Elemente gibt.
- Jede Atomsorte hat einen bestimmten Radius und eine bestimmte Masse.
- Chemische Reaktionen sind Teilchengruppierungen. Bei einer Reaktion gruppieren sich die Atome der Ausgangsstoffe lediglich um. Weder werden Atome vernichtet, noch entstehen neue.
- Bei chemischen Reaktionen verbinden sich die Atome verschiedener Elemente in bestimmten konstanten Zahlenverhältnissen.
Dieses Modell müsste um eine weitere Aussage erweitert werden:
- Atome können eine positive oder eine negative Ladung annehmen!
Damit könnten wir den obigen Versuch zwar erklären, aber eine richtige Erklärung wäre das noch nicht.
In der Lösung befinden sich positiv geladene Zink-Atome. Wenn sich dann am Minuspol der Zinkbaum bildet, werden aus diesen positiv geladenen Zink-Atomen plötzlich elektrisch neutrale "normale" Zink-Atome. Das selbe passiert am Pluspol. In der Lösung befinden sich negativ geladene Brom-Atome. Am Pluspol werden aus diesen negativen Teilchen aber plötzlich "normale" elektrisch neutrale Brom-Atome. Was geschieht während dieses Versuchs wirklich?
Eine Antwort auf diese Frage fand der britische Forscher JOSPEPH J. THOMSON (1856 - 1940). Mit seinem "Rosinenkuchenmodell" kann man die Elektrolyse von Zinkbromid (und viele andere chemische Vorgänge) gut erklären.
Seitenanfang -
Einleitung - Rosinenkuchenmodell -
Kern-Hülle-Modell -
Schalenmodell -
Periodensystem

