Schauen wir uns noch einmal die Zusammenfassung der vorhergehenden Seite an, auf der erklärt wurde, wie in den Mitochondrien ATP hergestellt wird:
Zusammenfassung
Die ATP-Synthese der Mitochondrien geschieht an der inneren Membran der Mitochondrien. Protonen strömen passiv aus dem Zwischenmembranraum (hohe H+-Konzentration) in die Mitochondrien-Matrix (geringere H+-Konzentration), und zwar durch ATP-Synthasen. Die in dem Konzentrationsunterschied gespeicherte Energie wird zur Synthese von ATP aus ADP und Pi eingesetzt.
Die ATP-Synthese in den Mitochondrien funktioniert also so ähnlich wie die Stromproduktion in einem Wasserkraftwerk. Daher kann man die Mitochondrien mit Recht als "Kraftwerke der Zelle" bezeichnen.
Bei einem Wasserkraftwerk befindet sich das Wasser normalerweise oben im Stausee und fließt dann mit Macht nach unten, wobei es Strom-Generatoren antreibt. Der Stausee wird in der Regel durch einen größeren Fluss gespeist, so dass immer wieder neues Wasser angeliefert wird.
Wenn wir uns jetzt ein Mitochondrium anschauen, haben wir eine etwas andere Situation, die gleich zwei Fragen aufwirft:
Frage 1:
Wie kommt eigentlich das Konzentrationsgefälle der Protonen zustande?
Frage 2:
Wieso bleibt die Konzentration der Protonen im Membranzwischenraum ständig so hoch? Wer sorgt für den Nachschub an Protonen?
Eigentlich sind die beiden Fragen miteinander verwandt. Derjenige Prozess, der für den Protonen-Nachschub sorgt, ist auch für den Aufbau des Konzentrationsgefälles verantwortlich.
Aktiver Transport der Protonen
Wenn die hohe Protonenkonzentration aufrecht erhalten werden soll, obwohl ständig Protonen aus dem Zwischenmembranraum in die Matrix diffundieren, dann müssen die Protonen irgendwie aktiv in den Zwischenmembranraum zurück transportiert werden.
Theoretisch würde das mit Hilfe von ATP funktionieren, so wie die anderen "normalen" aktiven Transportvorgänge in der Zelle. Dummerweise sollen die Mitochondrien aber ATP herstellen und nicht verbrauchen. Daher wäre es keine gute Idee, die hohe Protonenkonzentration im Zwischenmembranraum durch Verbrauch von ATP aufrecht zu erhalten.
Die grünen Pflanzen haben dieses Problem ganz einfach gelöst: Sie nutzen die im Sonnenlicht enthaltene Energie für diesen aktiven Transport, benötigen also kein ATP für die Aufrechterhaltung des Protonengradienten. Tiere und andere nicht photosynthetisch aktive Organismen haben diese Möglichkeit nicht, sie müssen auf andere Weise für den Protonen-Nachschub sorgen, ohne dazu ATP zu verbrauchen.
Wenn Sonnenlicht und ATP als Energielieferanten ausscheiden, was käme dann noch in Frage als Energielieferant für den aktiven Protonentransport.
Um diese Frage zu klären, müssen wir jetzt einen kleinen Ausflug in die Elektrochemie unternehmen.
Kleiner Ausflug in die Elektrochemie
Batterien und Akkumulatoren sind aus dem Alltag bekannte Energielieferanten. Auch in den Mitochondrien wird eine solche Stromquelle für den aktiven Protonentransport benutzt. Aber bevor wir hier die Einzelheiten klären, wollen wir uns noch einmal kurz klarmachen, wie eigentlich eine klassische Batterie funktioniert.
Die Zitronenbatterie
Im Schülerversuch kann man sich eine einfache Batterie basteln, indem man einen Zinkstab und einen Kupferstab in eine Zitrone sticht und die beiden Elektroden dann mit einem Voltmeter verbindet. Es wird eine deutliche Spannung angezeigt, und der Versuch ist als Zitronenbatterie bekannt.
Die Spannung kommt dadurch zustande, dass Zink ein unedles Metall ist und leicht Elektronen abgibt. Kupfer dagegen ist ein edles Metall, das leicht Elektronen aufnimmt.
Wenn das Zink nun Elektronen abgibt, wird die Zink-Elektrode positiv geladen. Und wenn das Kupfer Elektronen aufnimmt, wird die Kupfer-Elektrode negativ. Daher kann man eine Spannung zwischen den beiden Elektroden messen. "Spannung" ist nämlich nur ein anderes Wort für "Ladungsunterschied".
Eine noch größere Spannung könnten wir erzeugen, wenn wir nicht eine Zink-Elektrode und eine Kupfer-Elektrode in die Zitrone stechen würden, sondern eine Lithium-Elektrode und eine Silber-Elektrode. Lithium ist nämlich noch unedler als Zink und gibt seine Elektronen daher noch leichter ab, und Silber ist noch edler als Kupfer und nimmt Elektronen daher noch leichter auf. Der Ladungsunterschied und somit die Spannung zwischen Lithium und Silber wäre also noch viel größer als zwischen Zink und Kupfer.
Das Redoxpotenzial
Im Chemieunterricht der Oberstufe lernt man dann den Begriff des Redoxpotenzials kennen. Unter dem Redoxpotenzial versteht man ein Maß für die Fähigkeit eines Metalls, eines Nichtmetalls oder einer organischen Verbindung, Elektronen abzugeben und dadurch andere Stoffe zu reduzieren.
Stoffe, die Elektronen leicht abgeben, haben ein negatives Redoxpotenzial. Negativ deswegen, weil Elektronen negativ geladen sind. Redoxpotenziale werden immer in Volt oder Millivolt angegeben, weil man Redoxpotenziale mit Hilfe eines Voltmeters ermitteln kann (das ist jetzt nicht so ganz einfach, aber das soll uns jetzt mal egal sein).
Von den oben genannten vier Metallen hat Lithium das negativste Redoxpotenzial, nämlich -3,04 Volt. Das ist schon ein extremer Wert, alle anderen Metalle haben weniger negative oder sogar positive Redoxpotenziale. Aus diesem Grund wird das Element Lithium auch für die bekannten Lithium-Akkus eingesetzt.
Zink hat ein Redoxpotenzial von "nur" -0,762 Volt, das Redoxpotenzial ist also deutlich positiver als das von Lithium. Die Elektronen des Lithiums können daher ohne Probleme zu einer Zink-Elektrode fließen.
Kupfer hat sogar ein positives Redoxpotenzial und gehört damit zu den Edelmetallen. Das Redoxpotenzial von Kupfer beträgt + 0,34 Volt.
Und Silber hat das positivste Redoxpotenzial aller vier Metalle, es liegt bei +0,8 Volt.
Wenn man das Ganze graphisch darstellt, erhält man folgende Skizze:
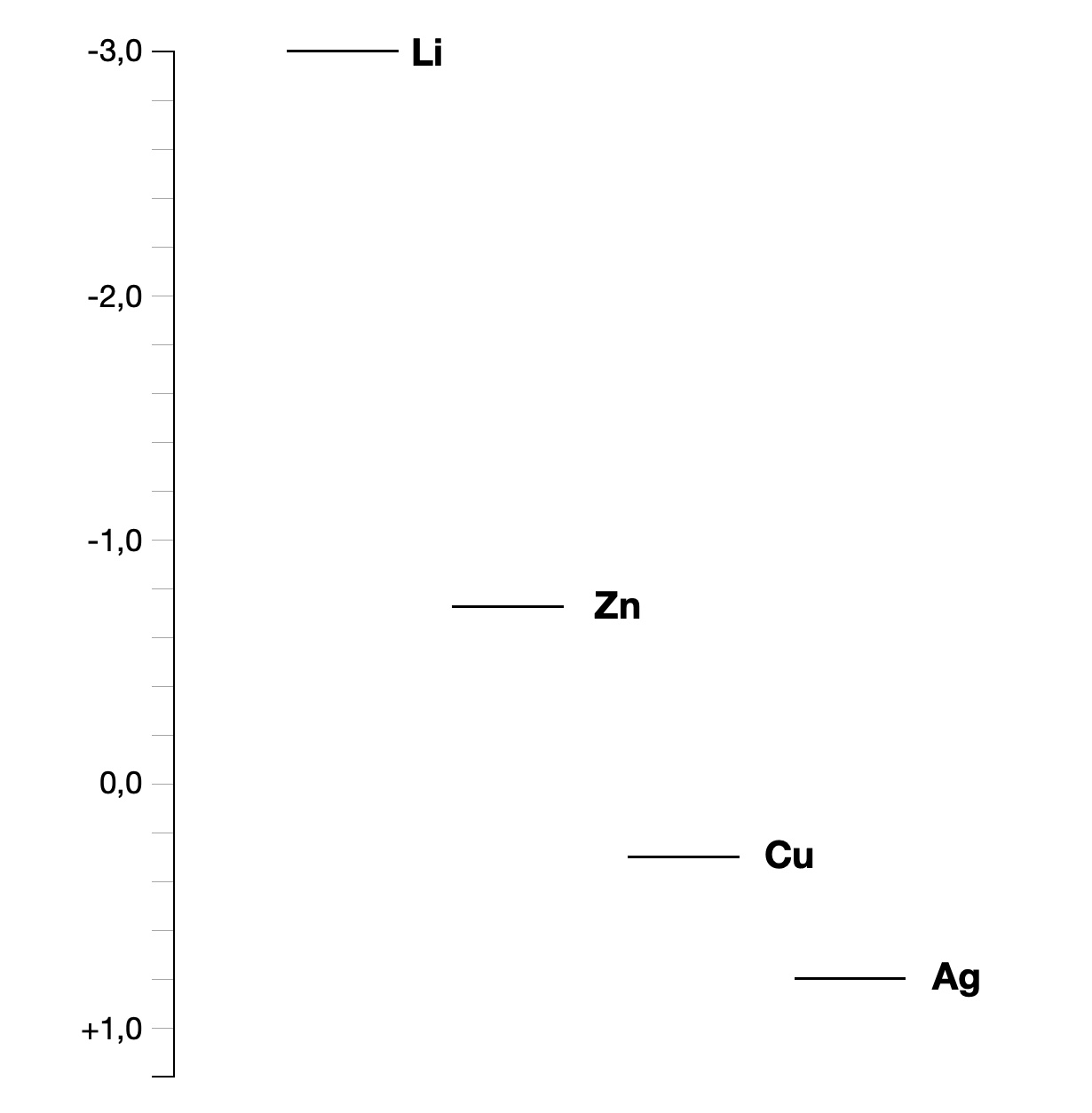
Die Redoxpotenziale einiger Metalle
Autor: Ulrich Helmich 09/2024, Lizenz: Public domain
Für Verwirrung bei einigen Schülern und Schülerinnen sorgt stets die Tatsache, dass die negativen Redoxpotenziale sich oben im Koordinatensystem befinden und die positiven unten. Aber daran muss man sich eben gewöhnen. So kann man sich besser vorstellen, dass die Elektronen vom Lithium zum Zink "fallen", also freiwillig und spontan fließen, ähnlich wie Wasser freiwillig und spontan den Berg herab fließt. Die Formulierung "Lithium hat ein höheres Redoxpotenzial als Zink" hört sich auf den ersten Blick zwar gut und anschaulich an, ist aber eigentlich falsch. Richtig müsste es heißen: "Lithium hat ein negativeres Redoxpotenzial als Zink".
Zusammenfassung
Elektronen können spontan und freiwillig von einem Stoff mit einem negativen Redoxpotenzial zu einem Stoff mit einem weniger negativen oder sogar positiven Redoxpotenzial fließen.
Nach diesem kleinen Ausflug in die Elektrochemie kommen wir wieder zurück zur Atmungskette.
Die Rolle der Elektronen in der Atmungskette
Wir hatten gesagt, der Protonentransport der Atmungskette wird von einer Art Batterie angetrieben, so dass kein ATP für diesen aktiven Transport verbraucht werden muss. In der Technik enthält eine Batterie meistens zwei verschiedene Metalle, ein unedles wie Lithium und ein edles wie Kupfer oder Silber. Was sind nun die Bestandteile der Atmungsketten-Batterie?
Auch organische Verbindungen sind in der Lage, Elektronen aufzunehmen oder Elektronen abzugeben. Denken Sie nur an die Oxidation eines Alkohols zum Aldehyd. Der Alkohol wird um zwei Stufen oxidiert, das heißt, die Alkohol-Moleküle geben zwei Elektronen ab. Und wenn ein Aldehyd zur Carbonsäure oxidiert wird, gibt der Aldehyd zwei Elektronen ab. Das Ganze funktioniert natürlich nur dann, wenn ein Oxidationsmittel in der Lösung vorhanden ist, das in der Lage ist, diese Elektronen aufzunehmen.
Also müsste man eigentlich auch für organische Verbindungen wie Alkohole, Aldehyde und Carbonsäuren ein Redoxpotenzial angeben können, und man müsste theoretisch sogar eine Batterie bauen können, deren Spannung durch einen Alkohol und eine Carbonsäure erzeugt wird.
Die innere Membran der Mitochondrien enthält solche Verbindungen mit Redoxpotenzialen, und zwar bestimmte Proteine. Allerdings keine einfachen Proteine, die nur aus einer Peptidkette bestehen, sondern teils sehr große Komplexe aus vielen Peptidketten. Einfallslos, wie manche Biologen sind, werden diese Proteinkomplexe als Komplex I, Komplex II, Komplex III und Komplex IV bezeichnet. Na ja, ganz so einfallslos sind die Biologen nicht, jeder dieser Komplexe hat auch noch einen richtigen Namen. Der Komplex I beispielsweise heißt NADH-Dehydrogenase-Komplex.
Dieser Komplex I in der inneren Mitochondrienmembran enthält eine Komponente namens Ubichinon, die ein Redoxpotenzial zwischen +0.08 und +0,10 Volt hat (je nach Fachbuch, in das man hineinblickt).
Das Endprodukt des Citratzyklus, das NADH, hat dagegen ein Redoxpotenzial von -0,32 Volt (da sind sich alle Fachbücher einig).
Das heißt, es können ohne Weiteres Elektronen vom NADH zum Ubichinon in dem Komplex I fließen. Und ähnlich wie in einer Batterie kann durch dieses Fließen von Elektronen Arbeit geleistet werden. Und jetzt dürfen Sie dreimal raten, welche Art von Arbeit dabei geleistet wird!
Richtig geraten! Der Komplex I nutzt die Energie, die in dem Redoxpotenzial-Unterschied NADH/Ubichinon gespeichert ist, um vier Protonen durch die Membran in den Zwischenmembranraum zu transportieren.
Wie das Ganze genau funktioniert, ist keine Sache für den Schulunterricht mehr und wird auf der entsprechenden Vertiefungsseite erklärt. Wichtig ist aber, dass die anderen Proteinkomplexe in der Mitochondrienmembran ähnlich arbeiten. Auch sie nutzen den Unterschied in den Redoxpotenzialen organischer Verbindungen aus, um Protonen aus der Matrix in den Zwischenmembranraum zu transportieren.
Zusammenfassung
Die Mitochondrien sind die "Kraftwerke" der Zelle. An der inneren Mitochondrienmembran wird ATP hergestellt. Dazu strömen Protonen aus dem Zwischenmembranraum durch bestimmte Enzyme, die ATPasen, in die Mitochondrien-Matrix. Die im Konzentrationsgradienten enthaltene Energie wird von den ATPasen zur Synthese von ATP aus ADP/Pi genutzt.
Erzeugt wird dieser Protonengradient durch mehrere Proteinkomplexe in der inneren Mitochondrien-Membran. Diese Proteinkomplexe pumpen Protonen aus der Matrix in den Zwischenmembranraum. Angetrieben wird dieser aktive Transport nicht durch ATP, was kontraproduktiv wäre, sondern durch die Differenz der Redoxpotenziale der beteiligten Komponenten wie NADH, Ubichinon, Cytochrom und so weiter - also quasi durch eine biochemische Batterie.
Auf der nächsten Seite schauen wir uns nun an, wie die innere Membran der Mitochondrien genau aufgebaut ist. Dazu schauen wir zunächst in die gängigen Schulbücher und anschließend in die anspruchsvollere Hochschul-Literatur.