In einer lebenden Zelle, die zu 70 bis 80% Wasser in ihrem Cytoplasma enthält, ist Wasser ein hervorragendes Lösemittel für anorganische und organische Ionen und Moleküle. Das liegt unter anderem an der Polarität des Wasser-Moleküls, wie auf der vorhergehenden Seite erklärt.
Wasser als Lösemittel für Ionen
Wasser-Moleküle sind Dipole, haben also ein negatives Ende (das O-Atom) und ein positives Ende (die beiden H-Atome). Warum lösen sich nun viele Salze so gut in Wasser?
Ein Salz besteht immer aus positiv geladenen Ionen, den Kationen, und aus negativ geladenen Ionen, den Anionen. Beim Natriumchlorid (NaCl, Kochsalz) zum Beispiel handelt es sich bei den Kationen um Natrium-Ionen Na+ und bei den Anionen um Chlorid-Ionen Cl-. Im festen NaCl bilden diese Ionen ein Kristallgitter, jedes Kation zieht viele Anionen an, und jedes Anion wiederum viele Kationen. Löst man NaCl in Wasser auf, wird dieses Kristallgitter zerstört, und die Ionen lösen sich im Wasser.
Nun sind die Anziehungskräfte zwischen den Ionen im Kristallgitter aber extrem stark. Die Gitterenergie zu überwinden, welche die Ionen zusammenhält, ist schon recht aufwendig. Wasser-Moleküle schaffen das aufgrund ihrer Polarität dennoch "mit links". Warum das so ist, zeigt das folgende Bild.
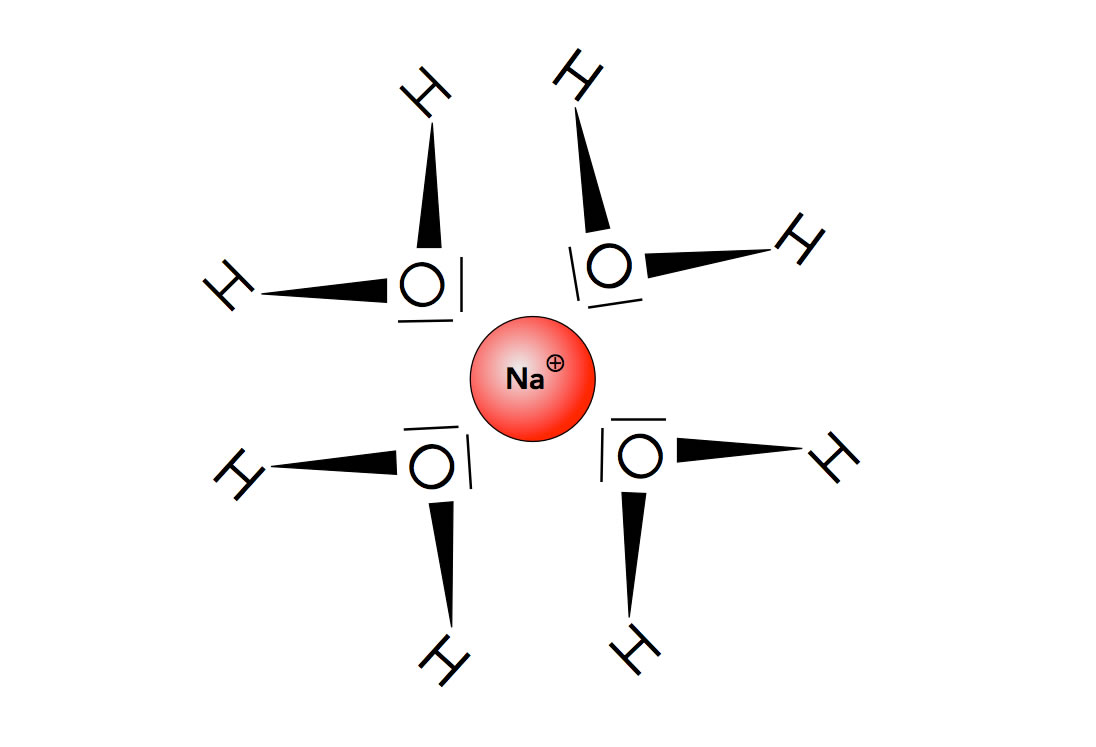
Hydrathülle um ein Natrium-Ion
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Die Wasser-Moleküle bilden eine sogenannte Hydrathülle um die Natrium-Ionen. Das Natrium-Ion ist positiv geladen. Die Wasser-Moleküle orientieren sich nun so, dass sie ihre negativen Pole (also die O-Atome) diesem Natrium-Ion zuwenden. Hier liegen keine Wasserstoffbrücken-Bindungen vor, sondern rein elektrostatische Anziehungskräfte.
Die Anionen werden ebenfalls von Wasser-Molekülen "umzingelt". Allerdings ist es hier genau umgekehrt. Die Wasser-Moleküle richten ihre positiv polarisierten H-Atome auf das negative Ion.
Immer dann, wenn eine chemische Bindung gespalten wird, ist ein gewisser Energiebetrag aufzubringen, die sogenannte Bindungsdissoziationsenergie (kurz: Bindungsenergie). Logischerweise muss umgekehrt, wenn eine neue Bindung entsteht, der gleiche Betrag wieder freigesetzt werden.
Wenn sich eine Hydrathülle um die Kationen und Anionen bildet, entstehen neue Bindungen. Es wird also ein gewisser Energiebetrag freigesetzt, die Hydrationsenergie. Das ist einer der beiden Gründe, warum sich Salze wie NaCl bei Zimmertemperatur in Wasser lösen. Die Hydrationsenergie kompensiert einen gewissen Teil der Gitterenergie.
Der Hauptgrund, warum sich ein Salzkristall in Wasser löst, ist aber ein anderer, nämlich die Zunahme der Entropie. In einem Salzkristall sind die Ionen in einem hoch geordneten Zustand angeordnet: sehr geringe Entropie (Entropie = Unordnung). Löst sich der Kristall aber in Wasser, schwirren die einzelnen Ionen im Lösemittel wild durcheinander. Das ist ein Zustand hoher Entropie (hoher Unordnung). Diese Entropie-Zunahme beim Lösen ist die eigentliche Triebkraft für das freiwillige Ablaufen des Lösungsvorgangs.
Für Chemie-Profis:
Bei chemischen Reaktionen unterscheidet man grundsätzlich zwischen der Reaktionsenthalpie ΔH und der freien Energie ΔG. Dabei ist folgende Gleichung wichtig:
ΔG = ΔH - T * ΔS
ΔS ist dabei die Entropiezunahme. Wenn man ein Salz wie NaCl in Wasser löst, ist zwar die Hydrationsenthalpie sehr hilfreich dabei, der Betrag kann jedoch die enorme Gitterenergie nicht kompensieren. Das heißt, die Gesamt-Reaktionsenthalpie ΔH, quasi das Ergebnis aus Gitterenergie und Hydrationsenthalpie, ist immer noch positiv, die Reaktion ist also endotherm. Da aber die Entropie beim Lösen des Salzes stark zunimmt, hat ΔS einen sehr großen Wert. Der Term T * ΔS wird nun von der Reaktionsenthalpie abgezogen, und da ΔS einen so hohen Wert hat, ist der Ausdruck -T * ΔS ziemlich negativ. Das wirkt sich dann auch auf ΔG aus; die freie Energie des Lösungsvorgangs nimmt ebenfalls einen negativen Wert an: ΔG < 0. Eine solche Reaktion mit ΔG < 0 wird als exergonisch bezeichnet (nicht zu verwechseln mit ΔH < 0 = exotherm).
Anorganische Ionen
In der lebenden Zelle sind viele verschiedene anorganische Ionen gelöst. Vor allem zu nennen wären hier Kalium K+(140 bis 150 mmol/l), Natrium Na+ (12 mmol/l) Magnesium Mg2+ (0,8 mmol/l) und sehr wenig Calcium Ca2+ (0,0002 mmol/l) [2]. Nicht vergessen sollte man die Protonen H+, die auch zu den anorganischen Ionen gehören. Allerdings ist die Protonenkonzentration in einem neutralen Medium sehr gering, bei einem pH von 7 liegt sie bei 10-7 mol/l oder 0,0000001 mol/l oder 0,0001 mmol/l.
Die wichtigsten anorganischen Anionen in der Zellflüssigkeit sind Chlorid Cl- (4 mmol/l) und Hydrogencarbonat HCO3- (12 mmol/l) und eine geringe Konzentration der verschiedenen Phosphate H2PO4-, HPO42- und PO43- (keine Konzentrationsangaben gefunden) [2].
Organische Ionen
Auch organische Ionen wie Acetat CH3COO-, Citrat und so weiter bilden Hydrathüllen. Allerdings ist hier nicht das ganze Ionen von einer Hydrathülle umgeben, sondern nur der Teil des Moleküls, der die negative Ladung trägt. Aber eine Hydrathülle besteht ja nicht nur aus einer einzigen Schicht von Wasser-Molekülen, so wie in der Abbildung 1 angedeutet, sondern die Wasser-Moleküle der ersten Schicht bilden Wasserstoffbrücken-Bindungen mit weiteren Wasser-Molekülen aus. Die Hydrathülle ist also deutlich größer als in der Abb. 1 gezeigt, das gilt dann auch für organische Anionen.
Bei Proteinen kommen nicht nur negative Ladungen vor, sondern auch positive. Die NH2-Gruppen der Aminosäuren haben basische Eigenschaften wegen des freien Elektronenpaars am Stickstoff-Atom. Daher kann eine NH2-Gruppe ein Proton aufnehmen und wird dann zur positiv geladenen NH3+-Gruppe. Um solche Gruppen können sich ebenfalls Hydrathüllen bilden.
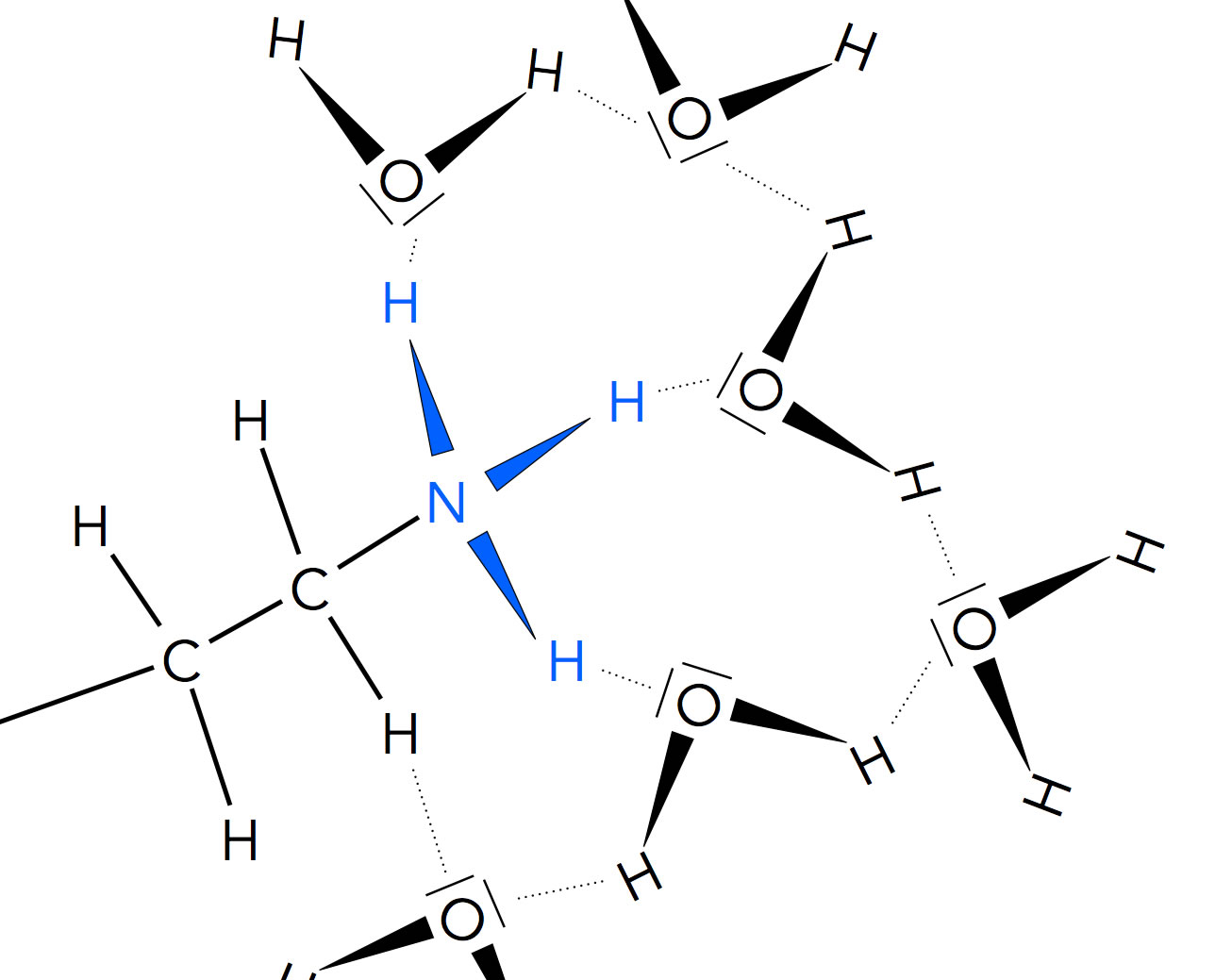
Hydrathülle um eine NH3+-Gruppe eines Proteins
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Solche Hydrathüllen spielen eine ganz wichtige Rolle bei der Ausbildung der Raumstruktur von Proteinen und anderen Makromolekülen im Zellplasma. Lange Proteine, die aus vielen Aminosäuren bestehen, "drehen und winden" sich so, dass möglichst viele geladene Seitenketten nach außen ragen, so dass sich viele Hydrathüllen bilden können. Dieser Zustand ist energetisch sehr günstig. Die Teile des Proteins, die keine Hydrathüllen ausbilden können, werden dagegen vorzugsweise nach innen verlagert.
Für Chemie-Profis:
Anziehungskräfte zwischen gelösten Ionen
Die Ionenbindung, wie sie beispielsweise in einem NaCl-Kristall vorkommt, ist eine sehr starke chemische Bindung. Sind die Ionen in Wasser oder einem anderen Lösemittel gelöst, sieht die Sache schon anders aus.
Grundsätzlich hängt die Stärke, mit der sich ein Kation und ein Anion in einem Lösemittel anziehen, von drei Faktoren ab:
- Abstand r zwischen den beiden Ionen.
- Ladung qK des Kations und Ladung qA des Anions.
- Dielektrizitätskonstante ε des Lösemittels.
Und hier die Formel, die alles ausdrückt:
$F = \frac{(q_K q_A)}{\varepsilon r^{2}} $
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Je größer der Abstand zwischen den beiden Ionen, desto kleiner die Anziehungskraft F - das klingt auf jeden Fall logisch. Interessant ist, dass die Anziehungskraft mit dem Quadrat des Abstands abnimmt. Also: doppelter Abstand = vierfach geringere Anziehungskraft, dreifacher Abstand = neunfach geringere Anziehungskraft.
Je größer die Ladungen der Ionen, desto stärker die Anziehungskraft. Das klingt auch logisch. Ein zweiwertig positives Calcium-Ion Ca2+ sollte ein Chlorid-Ion Cl- doppelt so stark anziehen wie ein einfach geladenes Natrium-Ion Na+ das tut.
Je größer die Dielektrizitätskonstante, desto geringer die Anziehungskraft F. Diese Dielektrizitätskonstante ist eine physikalische Eigenschaft des Lösemittels. Eine hohe Dielektrizitätskonstante bedeutet so viel wie: Die Moleküle des Lösemittels isolieren die beiden Ionen recht gut voneinander.
Wasser hat nun eine sehr geringe Dielektrizitätskonstante, der Wert liegt bei 78,5 (die Einheit ist dimensionslos!). Das ist ein sehr hoher Wert. Die Dielektrizitätskonstante von Benzol ist mit 4,6 sehr viel geringer.
Wasser isoliert die beiden Ionen also sehr gut. Das kann man jetzt mit den Hydrathüllen erklären. Diese wirken wie ein Isolator, die beiden entgegengesetzt geladenen Ionen haben kaum noch eine Chance, sie anzuziehen, weil die Hydrathüllen die elektrischen Ladungen gut abschirmen.
Würde man Natriumchlorid in Benzol lösen, dann könnten sich die Ionen viel stärker anziehen. Dumm nur, dass Benzol-Moleküle keine Benzol-Hülle um die Ionen bilden können und die Ionen so aus dem Kristallgitter herauslösen können. Natriumchlorid und andere Salze lösen sich so gut wie gar nicht in Benzol oder anderen Kohlenwasserstoffen.
Wasser löst keine hydrophoben Verbindungen
Gibt man etwas Wasser in einen Standzylinder und dann ein Alkan oder ein Alken (zum Beispiel Hexan bzw. Hexen), dann stellt man fest, dass sich die beiden Flüssigkeiten nicht mischen, es bilden sich zwei gut sichtbar getrennte Phasen. Das Alkan schwimmt wegen seiner geringeren Dichte auf dem Wasser.
Die Frage, die sich bei diesem Versuch immer stellt, ist die: Wieso vermischen sich die beiden Flüssigkeiten nicht?
Die Ursache dafür liegt in dem hydrophoben Effekt, der am besten mit der folgenden Abbildung erklärt werden kann:
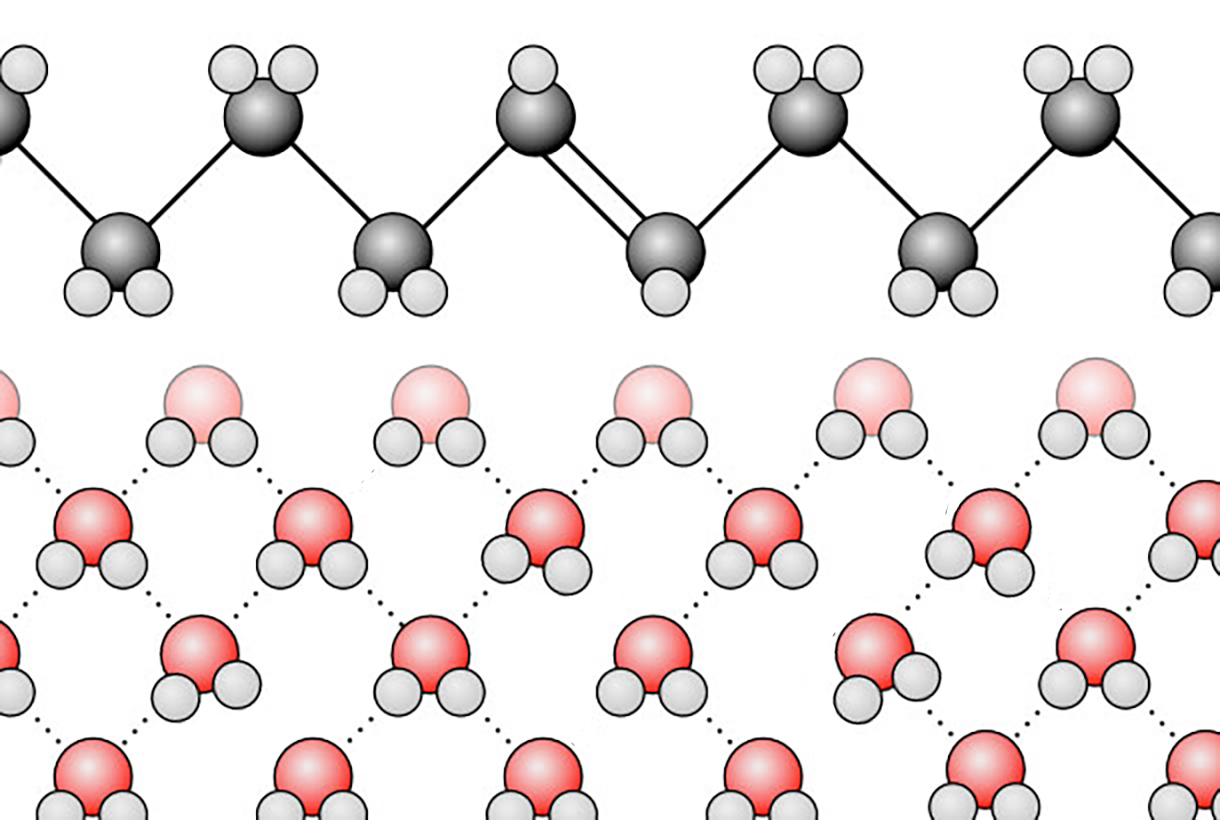
Veranschaulichung des hydrophoben Effekts
Autor: Ulrich Helmich, Lizenz: Public domain
Im Bild sehen wir einen vergrößerten Ausschnitt der Phasengrenze zwischen einem längerkettigen Alken und Wasser. Man achte auf die Wasserstoffbrücken-Bindungen zwischen den Wasser-Molekülen. Die Wasser-Moleküle, die sich "im Innern" der wässrigen Phase befinden, können jeweils maximal vier H-Brücken zu anderen Wasser-Molekülen ausbilden. Das ist unter Energie-Aspekten sehr günstig. Im Schnitt ist ein H2O-Molekül allerdings nur mit 3,4 anderen Wasser-Molekülen über H-Brücken verbunden.
Schauen wir uns nun die Wasser-Moleküle an, die sich an der Phasengrenze zum Alken befinden. Diese Wasser-Moleküle können maximal zwei H-Brücken zu benachbarten Wasser-Molekülen ausbilden.
Die H-Atome der Methylen-Gruppen des Alkens sind nicht in der Lage, H-Brücken zu bilden, weil sie nicht an einem elektronegativen N- oder O-Atom sitzen, sondern "nur" an einem C-Atom.
Die Wasser-Moleküle an der Phasengrenze sind also gegenüber den "inneren" Wasser-Molekülen energetisch benachteiligt. Daher "versuchen" sie, ebenfalls in das "Innere" des Wassers zu gelangen. Auf gar keinen Fall bilden sie dagegen Bindungen zu den Kohlenwasserstoff-Molekülen in der Alkan- oder Alken-Phase.
Dieses Phänomen, dass die Wasser-Moleküle "lieber unter sich" bleiben, weil das wegen der bis zu vier möglichen H-Brücken energetisch günstiger ist, bezeichnet man als hydrophoben Effekt.
Mehr zum hydrophoben Effekt erfahren Sie auf dieser Seite in meinem Chemie-Lexikon.
Der berühmte Römpp erklärt den hydrophoben Effekt wie folgt:
Der hydrophobe Effekt "beruht weniger auf anziehenden Kräften zwischen den hydrophoben Molekülen, sondern auf dem Effekt der Vermeidung einer ... Störung der Wasser-Struktur durch diese Moleküle. Man spricht deshalb auch von hydrophober Wechselwirkung." [3]
Wasser und amphipolare Substanzen
Was ist das denn schon wieder - eine amphipolare Substanz? Es gibt polare Verbindungen wie Essigsäure oder Ethanol. Mit ihren OH-Gruppen können diese Verbindungen H-Brücken mit Wasser-Molekülen bilden, daher lösen sich solche Stoffe sehr gut in Wasser. Diese Fähigkeit bezeichnet man auch als hydrophil (Wasser liebend).
Andere Stoffe wie Hexan, Benzol etc. haben überhaupt keine polaren Gruppe in ihren Molekülen, sie können keine H-Brücken mit Wasser-Molekülen bilden. Solche Stoffe unterliegen dann dem hydrophoben Effekt, der im letzten Abschnitt beschrieben wurde. Man bezeichnet solche unpolaren Verbindungen als hydrophob (Wasser abweisend).
Eine amphipolare Verbindung besitzt nun Moleküle, die sowohl einen hydrophilen Teil besitzen wie auch einen hydrophoben. Ein gutes Beispiel ist die Pentansäure. Die C-Kette aus fünf C-Atomen ist hydrophob, sie sieht so ähnlich aus wie das Alkan Pentan. Die COOH-Gruppe am Anfang des Moleküls ist dagegen hydrophil, denn sie besitzt eine OH-Gruppe wie Ethanol, mit der sie H-Brücken mit H2O-Molekülen bilden kann. Zusätzlich kann auch das Carbonyl-O-Atom der COOH-Gruppe H-Brücken mit Wasser-Molekülen bilden.
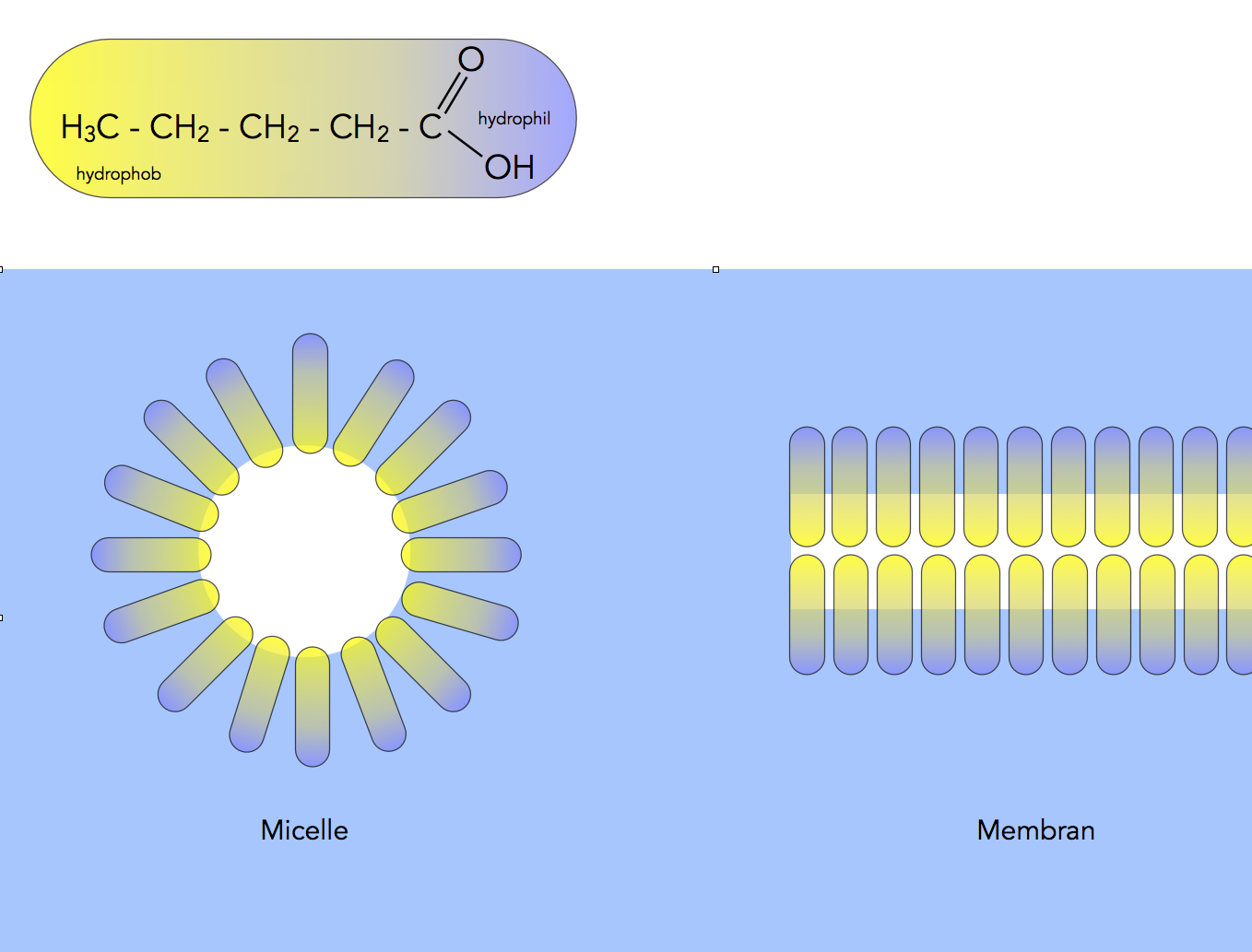
Verhalten von amphipolaren Verbindungen in Wasser
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Oben im Bild sehen wir die Strukturformel eines Pentansäure-Moleküls, der hydrophobe Bereich wurde gelb unterlegt, der kleinere hydrophile blau.
Wie verhalten sich solche Verbindungen, wenn man sie mit Wasser vermischt? Es gibt hier mehrere Möglichkeiten, die beiden bekanntesten sind die Bildung von Micellen und die Bildung von Membranen. Membranen spielen in der Biologie eine sehr wichtige Rolle, wie Sie vielleicht schon in dem Abschnitt über den Aufbau von Zellen gelesen haben: Jede Zelle ist von einer Membran umgeben, und die meisten Zellorganellen auch.
In beiden Fällen ordnen sich die amphipolaren Moleküle so an, dass die hydrophoben Bereiche möglichst vor dem Wasser geschützt sind. Bei der Micelle bilden die Moleküle eine Art Kreis, zumindest wenn man das Ganze zweidimensional darstellt wie auf der Zeichnung oben. In Wirklichkeit muss man sich hier natürlich eine Kugel vorstellen, aber das zu zeichnen, war mir einfach zu aufwendig. Außerdem hätte man dann das wasserfreie Innere der Kugel nicht gesehen.
Bei der Membran ordnen sich die Moleküle in zwei Schichten an, man spricht daher auch von einem Bilayer (einer Doppelschicht). Die hydrophoben Bereiche der Moleküle befinden sich gur vor Wasser geschützt in der inneren Schicht, die hydrophilen sind nach außen hin zum Wasser ausgerichtet, und zwar auf den beiden Seiten des Bilayers.
Wie eine Zellmembran wirklich aussieht, erfahren Sie auf dieser Seite über verschiedene Membranmodelle.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- engl. Wikipedia, Artikel "Cytosol"
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
Weiter mit dem Thema "Wasser" geht es jetzt nicht mehr. Ich denke, für den Bio-GK und den Bio-LK sollte das dicke reichen, was auf den beiden Seiten zu lesen ist, und für Studienanfänger der Fächer Medizin, Biologie, Pharmazie etc. ebenfalls.