Beispiel Carboxylat-Ion
Im Schulunterricht wird oft die Stabilisierung des Carboxylat-Ions CH3-COO- durch die Existenz von zwei Grenzstrukturen als "mesomerer Effekt" bezeichnet.
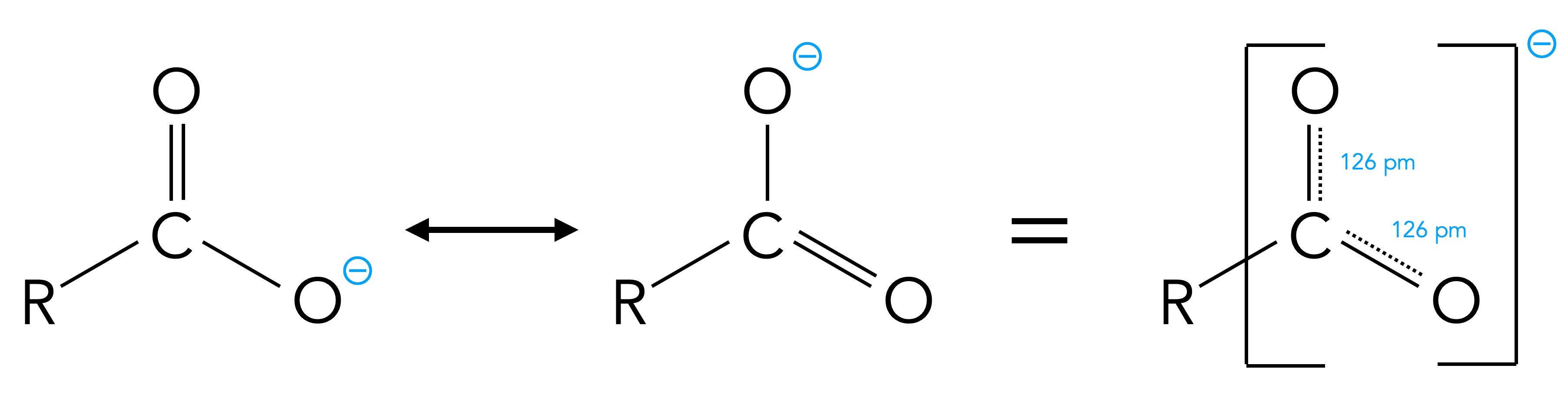
Die beiden Grenzstrukturen des Carboxylat-Ions
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Die negative Ladung des Carboxylat-Ions verteilt sich hier über drei Atome, daher ist das Ion stabiler, als wenn die Ladung an einem Atom lokalisiert wäre. Und dies ist auch der Grund dafür, dass die Carboxy-Gruppe so leicht ein Proton abspalten kann. Bei Alkoholen treten keine Grenzstrukturen auf, wenn die OH-Gruppe ein Proton abgibt. Daher sind Alkohole wesentlich schwächere Säuren als Carbonsäuren.
Ob es sich bei diesem Beispiel wirklich um einen "mesomeren Effekt" handelt, sei einmal dahingestellt. In der Oberstufenchemie versteht man unter einem +M- bzw. einem -M-Effekt etwas anderes, nämlich die Erhöhung der Elektronendichte durch Ausbildung zusätzlicher Grenzstrukturen durch einen Substituenten, wenn es um eine elektrophile Reaktion geht. Dies solle am Beispiel Phenol erläutert werden.
Der +M-Effekt am Beispiel Phenol
Wenn im Oberstufen-Unterricht die Aromaten behandelt werden und man zur Elektrophilen Substitution kommt, führt man oft den Versuch durch, bei der Toluol (der Ersatzstoff für Benzol) bromiert wird. Damit die Reaktion überhaupt abläuft, muss man Eisenspäne zusetzen, die dann als Katalysator fungieren.
In einer der nächsten Stunden führt man dann den gleichen Versuch mit Phenol anstelle von Toluol durch. Und hier läuft die Reaktion wesentlich schneller ab, obwohl kein Katalysator zugegeben wird.
Fragt man die Schüler vorher nach ihrer Meinung, ob die Bromierung von Phenol langsamer, genau so schnell oder schneller verläuft als die Bromierung von Toluol, dann werden die guten Schüler schnell antworten, dass die Phenol-Bromierung langsamer verlaufen muss, weil ja die OH-Gruppe einen -I-Effekt auf den Benzolring ausübt, also die Elektronendichte verringert und somit die Reaktivität der pi-Elektronen herabsetzt.
Führt man dann den Versuch durch, kommt genau das Gegenteil dieser Annahme heraus. An dieser Stelle des Unterrichts wird dann der +M-Effekt eingeführt, der positive mesomere Effekt.
Am besten macht man sich diesen Effekt mit folgender Abbildung klar:
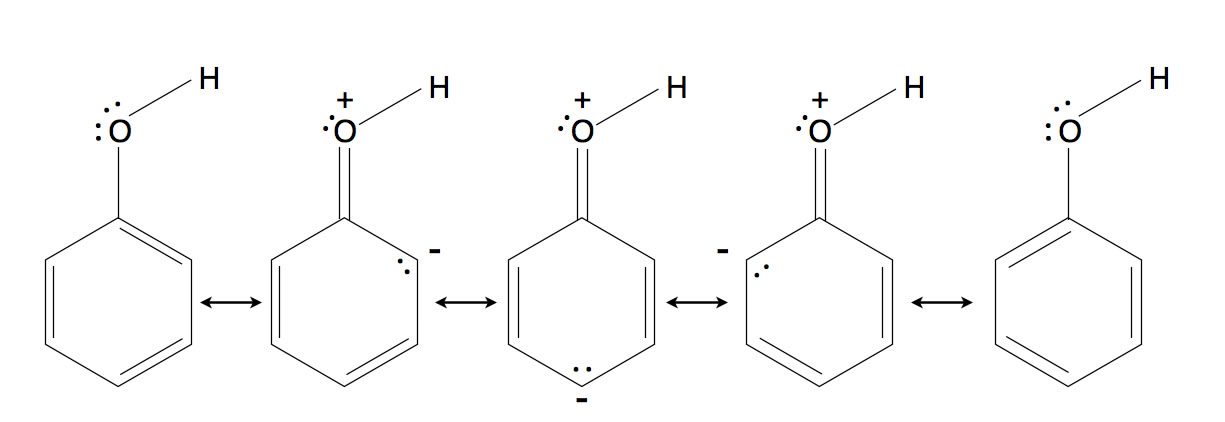
Die Grenzstrukturen des Phenol-Moleküls
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Auf dem Bild sehen wir die fünf Grenzstrukturen des Phenol-Moleküls. Bei drei der Grenzstrukturen bildet das O-Atome eine Doppelbindung zum Benzolring aus, dabei wird es positiv geladen, während der Benzolring eine negative Ladung übernimmt. Man spricht hier auch von einer Ladungstrennung.
Durch diese negative Ladung wird die Elektronendichte im Benzolring natürlich stark erhöht. Im Vergleich zum elektronenziehenden -I-Effekt der OH-Gruppe wirkt sich dieser elektronenschiebende +M-Effekt (positiver mesomerer Effekt) viel stärker auf die Elektronendichte aus. Die Reaktivität des Moleküls wird also durch den +M-Effekt stark erhöht, so dass die Bromierung von Phenol ohne Katalysator ablaufen kann.
Der -M-Effekt am Beispiel Benzoesäure
Die Benzoesäure zeigt nun das Gegenteil eines +M-Effekts. Betrachten wir dazu die folgende Abbildung:
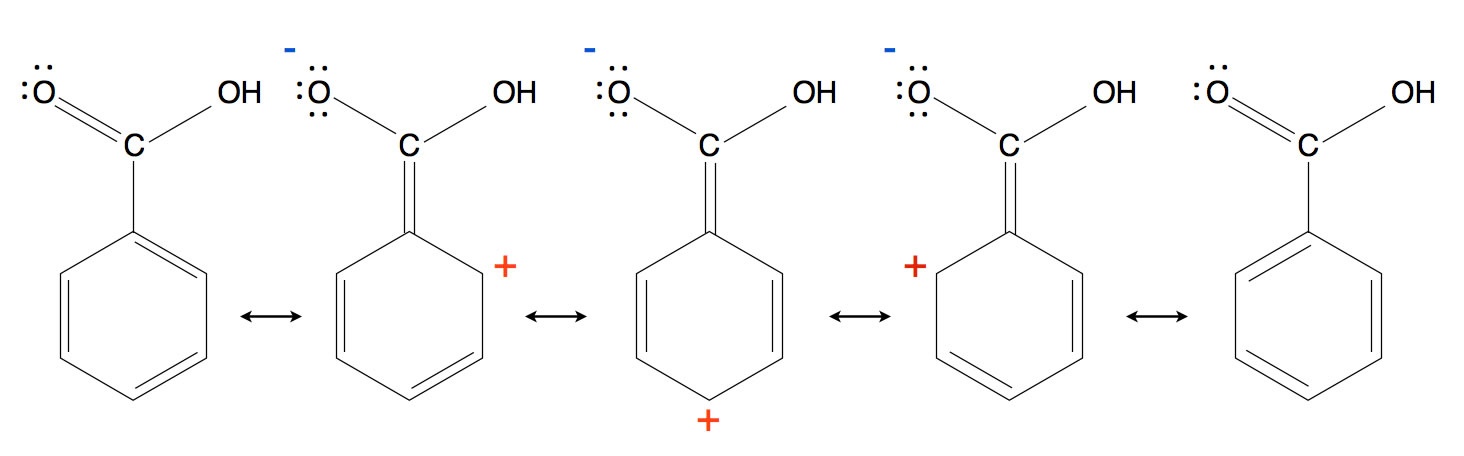
Die Grenzstrukturen der Benzoesäure
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Bei drei dieser Grenzstrukturen verliert das O-Atom seine Doppelbindung zum C-Atom der Carboxy-Gruppe und übernimmt eine negative Ladung. Das C-Atom der Carboxy-Gruppe bildet eine C=C-Doppelbindung zum Benzolring aus, und dieser übernimmt eine positive Ladung. Hier findet also wieder eine Ladungstrennung statt. Durch die positive Ladung hat sich allerdings die Elektronendichte des Benzolrings drastisch verringert, und entsprechend leidet die Reaktivität der Verbindung. Man spricht hier daher von einem -M-Effekt.
Mesomere Effekte bei nucleophilen Reaktionen
Das was wir eben über den +M- und den -M-Effekt gesehen haben, gilt auch für nucleophile Umsetzungen, wenn also ein Nucleophil eine Doppelbindung oder ein positiv polarisiertes C-Atom angreift - allerdings mit umgekehrten Vorzeichen. Nucleophile greifen ja dort an, wo die Elektronendichte besonders gering ist. Wenn nun also ein Substituent durch Ausbildung zusätzlicher Grenzstrukturen die Elektronendichte in dem Molekül erniedrigt, wird dadurch die Reaktivität der Verbindung gegenüber Nucleophilen erhöht. Man müsste hier also eigentlich auch von einem +M-Effekt sprechen.
Leider ist es nun aber so, dass sich die offizielle Definition des +M-Effekts auf die Erhöhung der Elektronendichte durch Grenzstrukturen bezieht. Ein +M-Effekt verringert also die Reaktivität gegenüber Nucleophilen und erhöht sie gegenüber Elektrophilen.