Die elektrophile Substitution am Benzolring wurde auf der letzten Seite besprochen. Wenn der Benzolring allerdings bereits mit einer anderen funktionellen Gruppe "besetzt" ist, mit einem sogenannten Primärsubstituenten, dann hat das durchaus Einfluss auf den Verlauf der Reaktion. Ein solcher bereits vorhandener Substitutent, zum Beispiel eine OH-Gruppe wie beim Phenol, eine NH2-Gruppe wie beim Anilin oder eine COOH-Gruppe wie bei der Benzoesäure, kann die Reaktivität des Benzolringes erhöhen oder erniedrigen, und sie kann beeinflussen, welche C-Atomen des Benzolringes das Elektrophil angreift.
Bei dem Einfluss von Primärsubstituenten sind folgende drei Effekte zu unterscheiden:
Diese drei Effekte können zwei verschiedene Arten von Wirkungen haben:
- Aktivierende oder desaktivierende Wirkungen
- Dirigierende Wirkungen
Induktive Effekte
Der erste Schritt bei der elektrophilen Substitution ist die Bildung des σ-Komplexes. Durch die hohe Elektronendichte der π-Elektronen werden Elektrophile angezogen und setzen sich an ein sp2-hybridisiertes C-Atom des Benzolrings, dabei entsteht der σ-Komplex. Eine entscheidende Rolle spielt hierbei die hohe Elektronendichte des Benzolringes.
Wenn der Benzolring nun bereits mit funktionellen Gruppen wie -OH, -NH2, -COOH, -CH3 u.a. verbunden ist - mit sogenannten Primärsubstituenten - so haben diese einen Einfluss auf die Elektronendichte im Benzolring, entweder durch einen positiven oder durch einen negativen induktiven Effekt.
Wirkung auf den Benzolring
Primärsubstituenten mit einem -I-Effekt erniedrigen die Elektronendichte im Benzolring und vermindern daher die Reaktivität des Aromaten = desaktivierende Wirkung. Die Bromierung von Nitrobenzol C6H5-NO2 oder Chlorbenzol C6H5-Cl verläuft daher langsamer als die Bromierung von Benzol C6H5-H.
Primärsubstituenten mit einem +I-Effekt erhöhen die Elektronendichte des Benzolringes und machen die Bildung des π-Komplexes leichter = aktivierende Wirkung. Die Bromierung von Toluol verläuft daher schneller als die Bromierung von Benzol.
Kritische Anmerkung für Experten:
Induktive Effekte wirken sich eigentlich nur auf das System der σ-Elektronen aus; für die SE sind aber die π-Elektronen des Benzolrings verantwortlich. Dennoch verläuft die Bromierung von Toluol C6H5-CH3 schneller als die Bromierung von Benzol.
Auf meiner Lexikon-Seite "Induktiver Effekt" finden Sie auch eine Übersicht, welche Gruppen welchen Effekt zur Folge haben.
Für Experten:
Achten Sie darauf, dass manche Gruppen ihre Ladung ändern können, wenn sich der pH-Wert des Lösungsmittels ändert. Aus einer neutralen COOH-Gruppe wird zum Beispiel eine negative -COO- - Gruppe, wenn man eine Base (Protonenakzeptor) dazugibt. Aus einer NH2-Gruppe kann beim Zusetzen einer Säure (Protonendonator) eine -NH3+-Gruppe werden.
Unterrichts-Material:
Dieses Thema habe ich für meine Schüler auch als einseitiges Arbeitsblatt gestaltet, das Sie sich gerne hier herunterladen können: "Induktive Effekte".
Mesomere Effekte
Ein Widerspruch...
Wenn man Phenol bromiert, stellt man fest, dass die Reaktion wesentlich schneller abläuft als die Bromierung von Benzol, manche Autoren sprechen sogar von 1000fach höherer Geschwindigkeit. Das ist jedoch nicht zu verstehen, da die OH-Gruppe zu den Substituenten mit einem negativen induktiven Effekt gehört. Eigentlich sollte die Bromierung von Phenol langsamer verlaufen als die Bromierung von Benzol.
... und seine Klärung
Wie immer in solchen Situationen sollte man sich schnell auf die Suche nach weiteren Einflussfaktoren machen. Im Falle der elektrophilen Substitution spielen nämlich nicht nur induktive Effekte eine wichtige Rolle, sondern auch die sogenannten mesomeren Effekte. Was mesomere Effekte sind, habe ich auf meiner Lexikonseite "Mesomerie" erklärt. Noch besser ist die Erklärung in dem SimpleChemics-Film zur Mesomerie.
+M-Effekt beim Anilin
Schauen wir uns einmal das Anilin-Molekül an:
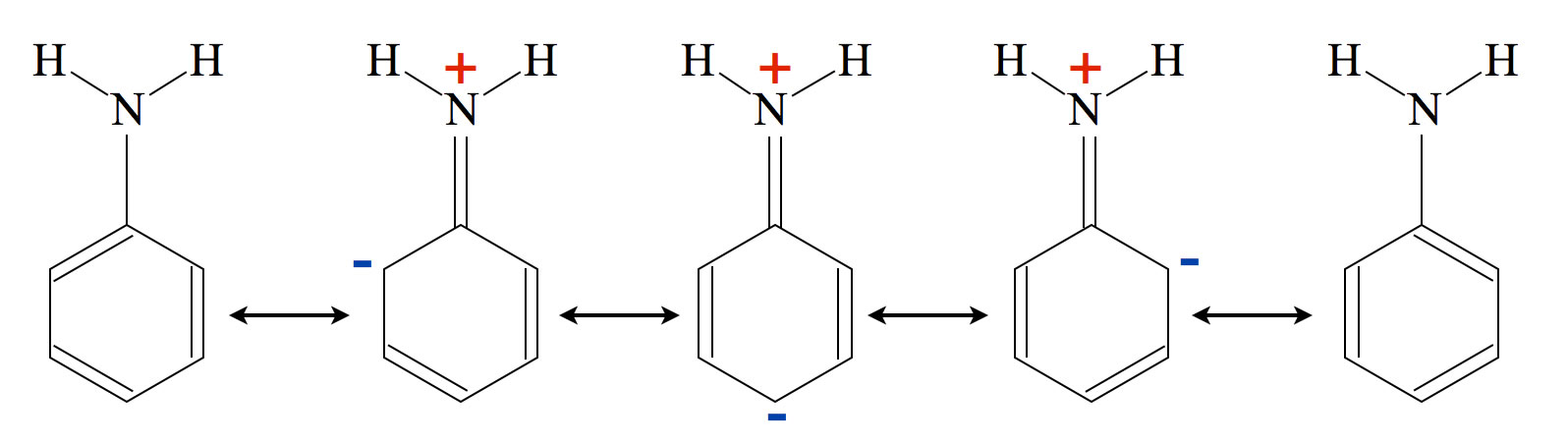
Fünf Resonanzstrukturen des Anilin-Moleküls
Wir können fünf verschiedene Grenzstrukturen oder Resonanzzstrukturen des Anilin-Moleküls zeichnen, bei dreien davon tritt eine sogenannte Ladungstrennung auf. Die positive Ladung befindet sich am N-Atom, während sich die negative Ladung auf drei C-Atome des Benzolrings konzentriert. Diese drei C-Atome sind nun geradezu prädestiniert, eine positive Ladung aufzunehmen, wenn sich im Laufe einer elektrophilen Addition der Sigma-Komplex bildet.
Der +M-Effekt aktiviert und dirigiert die Substitution in o- und p-Richtung
Dieser positive mesomeren Effekt (hervorgerufen durch energetisch günstige Resonanzstrukturen, auch als +M-Effekt bekannt) aktiviert nicht nur die elektrophile Substitution an sich (vermindert also die Aktivierungsenergie für die Bildung des Sigma-Komplexes und beschleunigt dadurch die Reaktion), sondern er dirigiert auch noch den Zweitsubstitutenten. Bei der Bromierung von Anilin bilden sich bevorzugt 2-Brom-Aminobenzol und 4-Brom-Aminobenzol.
Der +M-Effekt eines Erstsubstituenten aktiviert die elektrophile Substitution durch Einbringen einer negativen Ladung in den Benzolring (Erhöhung der Elektronendichte).
Gleichzeitig dirigiert der +M-Effekt die Substitution in para- und ortho-Richtung, weil sich die eingebrachte negative Ladung an diesen C-Atomen konzentriert.
-M-Effekt bei der Benzoesäure

Die fünf Grenzstrukturen der Benzoesäure
Die C=O-Doppelbindung der Benzoesäure ist verantwortlich dafür, dass negative Ladungen aus dem Benzolring abgezogen werden, zumindest bei drei der fünf Grenzstrukturen. Dieser mesomere Effekt verringert die Elektronendichte im Ring und wird daher als negativer mesomerer oder -M-Effekt bezeichnet.
Der -M-Effekt sorgt dafür, dass sich die positive Ladung bevorzugt in ortho- und para-Position aufhält. Beim +M-Effekt waren diese Positionen besonders günstig für die Bildung des sigma-Komplexes, beim -M-Effekt sind diese Positionen besonders ungünstig. Die Folge: Primärsubstituenten mit -M-Effekt dirigieren den zweiten Substituenten von der ortho- und para-Position weg, übrig bleibt dann nur noch die meta-Position.
Der -M-Effekt eines Erstsubstituenten desaktiviert die elektrophile Substitution durch Einbringen einer positiven Ladung in den Benzolring (Verringerung der Elektronendichte).
Gleichzeitig dirigiert der -M-Effekt die Substitution in meta-Richtung, weil sich die eingebrachte positive Ladung an der ortho- und para-Position konzentriert.
Zusammenfassung
+M-Substituenten aktivieren und dirigieren den Zweitsubstituenten in die ortho- und para-Position, -M-Substituenten desaktivieren und dirigieren den Zweitsubstituenten in die meta-Position.
Unterrichts-Material:
Dieses Thema habe ich für meine Schüler auch als einseitiges Arbeitsblatt gestaltet, das Sie sich gerne hier herunterladen können: "Mesomere Effekte".
Sterische Effekte
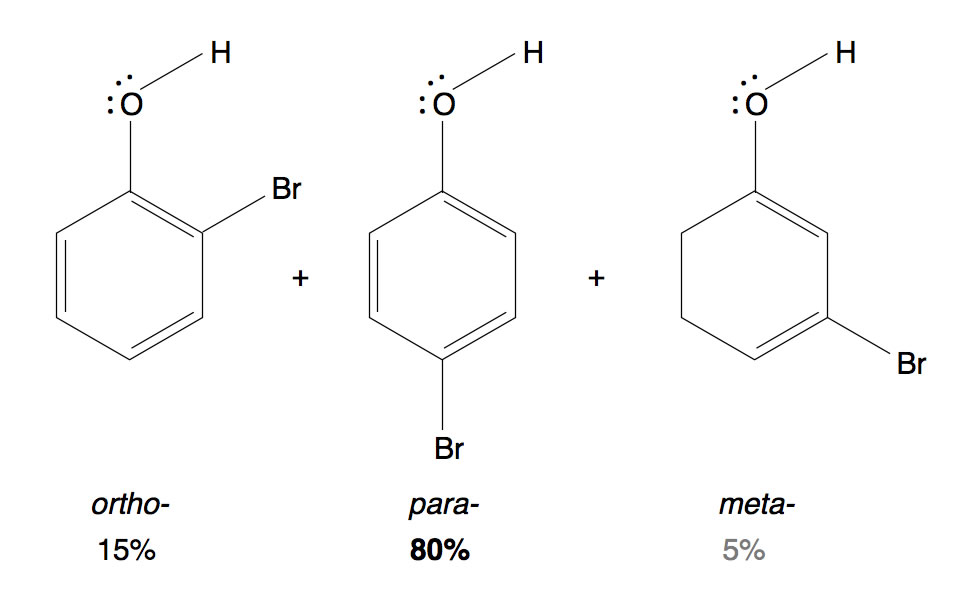
Die drei möglichen Bromphenole: ortho, meta und para
Die Bromierung von Phenol läuft ziemlich schnell ab, obwohl der -I-Effekt der OH-Gruppe an sich desaktivierend wirkt. Der +M-Effekt der OH-Gruppe ist jedoch wesentlich stärker, so dass insgesamt die Aktivierung überwiegt. Außerdem dirigiert der +M-Effekt die Substitution in ortho- und para-Richtung; das meta-Produkt wird nur zu ca. 5% gebildet.
Interessant ist jedoch die Frage, wieso überwiegend das para-Produkt gebildet wird. Sollten nicht gleich viel ortho- und para-Produkt entstehen?
Hier kommt ein neuer Effekt zum Tragen. Neben dem induktiven und dem mesomeren Effekt gibt es bei chemischen Reaktionen immer auch einen sterischen Effekt. Bei vielen einfachen Reaktionen spielt der sterische Effekte keine besonders große Rolle, bei diesem Beispiel aber schon. Das O-Atom der OH-Gruppe ist recht elektronegativ, das Br-Atom ebenfalls. Man muss sich beide Atome mit einer negativen Ladungswolke umgeben denken. Dann ist das ortho-Produkt energetisch ungünstiger als das para-Produkt, denn beim ortho-Produkt sind sich die beiden negativen Ladungswolken näher als beim para-Produkt.
Unterrichts-Material:
Dieses Thema habe ich für meine Schüler auch als einseitiges Arbeitsblatt gestaltet, das Sie sich gerne hier herunterladen können: "Dirigierende Effekte".
