Unter dem Fachbegriff "kovalente Bindung" versteht man eine chemische Bindung zwischen zwei Atomen, bei der sich die beiden Atome zwei Bindungselektronen teilen.
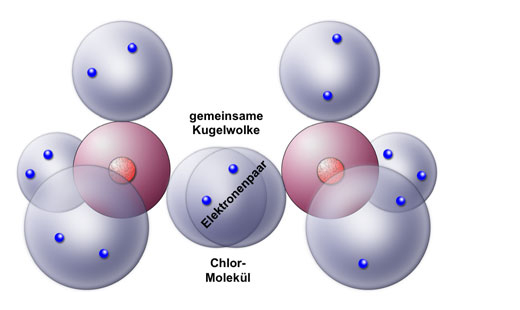
Hier eine Beschreibung der kovalenten Cl-Cl-Bindung im Cl2-Molekül nach dem Kugelwolkenmodell:
Jedes Chlor-Atom besitzt auf der Außenschale vier Kugelwolken. Drei davon sind mit Elektronenpaaren besetzt, eine Kugelwolke aber enthält nur ein Elektron. Bei der kovalenten Bindung überlappen nun die beiden einfach besetzten Kugelwolken der beiden Chlor-Atome und bilden eine gemeinsame Kugelwolke, die mit zwei Elektronen gefüllt ist. Man spricht hier auch von einem bindenden Elektronenpaar. Aus diesem Grund wird die kovalente Bindung auch sehr oft als Elektronenpaarbindung bezeichnet. Seltener wird die kovalente Bindung als Molekülbindung bezeichnet (weil sie nur in Molekülen vorkommt, nicht aber in Metallen oder Kristallgittern).
Unpolare Bindung
Beim Chlor-Molekül haben beide Atome die gleiche Elektronegativität, ziehen also die beiden Bindungselektronen gleich stark an. Die Folge ist, dass sich die beiden Elektronen gleichmäßig verteilt in der gemeinsamen Kugelwolke aufhalten.
Polare Bindung
Haben die beiden Atome der kovalenten Bindung jedoch unterschiedliche EN-Werte, wie im Beispiel Sauerstoff-Wasserstoff (OH-Gruppe, Wasser-Molekül), so halten sich die beiden Bindungselektronen statistisch öfter in der Nähe des elektronegativeren Atoms (in diesem Fall also Sauerstoff) auf. Die gemeinsame Kugelwolke hat dann ein leicht negatives und ein leicht positives Ende. Eine solche kovalente Bindung wird auch als polare Bindung bezeichnet.
Polare Bindung und elektrostatische Anziehung
Bei polaren kovalenten Bindungen kommt zu der eigentlichen kovalenten Bindung (durch die beiden Bindungselektronen) noch ein zweiter bindender Anteil dazu, nämlich die elektrostatische Anziehung der beiden polarisierten Atome.
Beim HF-Molekül, um mal nur ein Beispiel zu nennen, werden die beiden Atome grundsätzlich durch die beiden Bindungselektronen zusammengehalten, die wie eine Art Kit wirken. Das ist der Anteil der kovalenten Bindung. Die folgende Abbildung zeigt dies noch einmal deutlich:
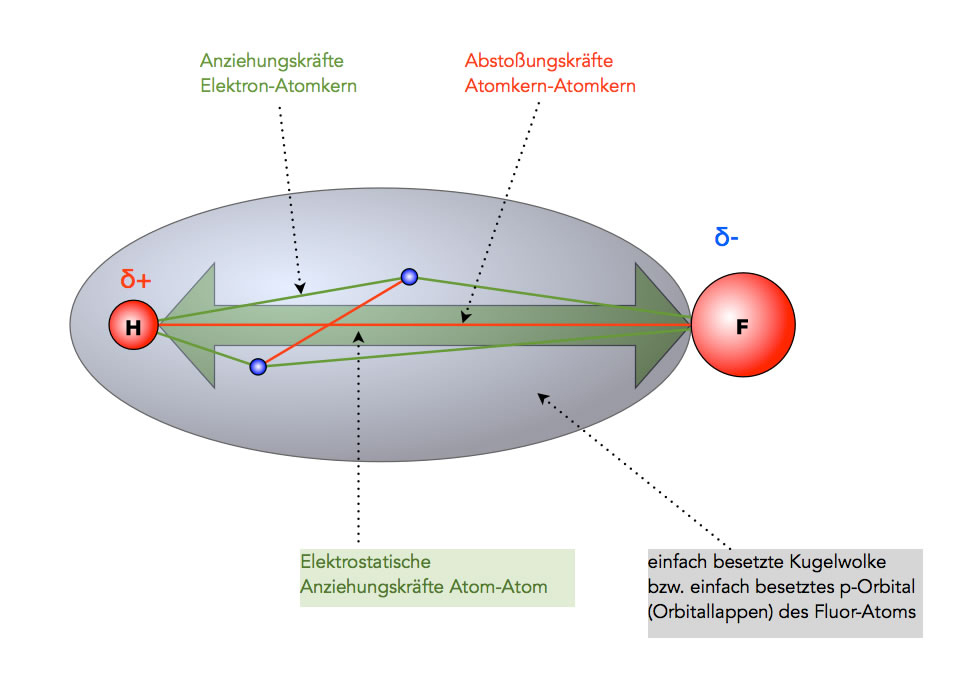
Anziehungskräfte im HF-Molekül
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Kovalente Bindung: Die Anziehungskräfte zwischen den Bindungselektronen und den beiden Atomkernen überwiegen die Abstoßungskräfte zwischen den Elektronen bzw. zwischen den Atomkernen. So kommt die kovalente Bindung zustande.
Elektrostatische Anziehung: Im HF-Molekül ist aufgrund der sehr unterschiedlichen Elektronegativitäten das F-Atom stark negativ polarisiert, während das H-Atom stark positiv polarisiert ist. Diese beiden entgegengesetzt polarisierten Atome ziehen sich nun elektrostatisch gegenseitig an.
Je größer der EN-Unterschied zwischen den beiden kovalent verbundenen Atomen, desto größer ist auch der Anteil der elektrostatischen Anziehung an der Atombindung. Aus diesem Grund ist zum Beispiel die Bindungsdissoziationsenergie der H-Br-Bindung deutlich geringer als die der H-F-Bindung. Der EN-Unterschied zwischen H und Br ist nämlich kleiner als der EN-Unterschied zwischen H und F, somit ist auch der elektrostatische Anteil in der H-Br-Bindung recht klein im Vergleich zur H-F-Bindung.