Dieser Lexikon-Artikel basiert auf dem entsprechenden Wikipedia-Artikel, ist jedoch didaktisch reduziert und aus anderen Quellen ergänzt worden, so dass ihn auch Schüler(innen) der gymnasialen Oberstufe und Studierende in den ersten Semestern verstehen können.
Das HSAB-Konzept ist eine Verfeinerung des Säure-Base-Konzepts von Lewis.
➥Lewis-Basen
Wenn Sie mit dem Lewis-Konzept nicht vertraut sind, sollten Sie sich diese beiden einführenden Seiten durchlesen.
Der Begriff HSAB steht für "Hard and Soft Acids and Bases", auf Deutsch also "Harte und weiche Säuren und Basen". Dieses neue Säure-Base-Konzept wurde 1963 von dem amerikanischen Chemiker Ralph G. Pearson veröffentlicht.
Was sind harte bzw. weiche Säuren und Basen?
Gemeint ist mit Sicherheit nicht der Aggregatzustand der Verbindung bei Zimmertemperatur. Zitronensäure ist also keine harte Säure, weil sie bei Raumtemperatur fest ist. Vielmehr geht es um die Polarisierbarkeit der Moleküle.
Stellen wir uns einmal ein Chlorwasserstoff-Molekül und ein Bromwasserstoff-Molekül vor. Chlor-Atome haben einen Radius von 79 pm, Brom-Atome einen Radius von 94 pm, sind also deutlich größer, weil sie ja eine Elektronenschale mehr haben als Chlor-Atome.
Die Außenelektronen des Brom-Atoms sind weiter vom Atomkern entfernt als die Außenelektronen des Chlor-Atoms. Darum werden die Außenelektronen des Broms nicht mehr so stark vom Atomkern angezogen wie die Außenelektronen des Chlors. Das wiederum heißt, das Brom-Atom ist leichter polarisierbar als das Chlor-Atom. Durch elektrische Felder (wenn zum Beispiel ein Dipol-Molekül in die Nähe kommt) können die Außenelektronen des Brom-Atoms daher leichter "verschoben" werden als die Außenelektronen des Chlor-Atoms. Beim noch größeren Iod-Atom ist die Polarisierbarkeit noch größer, und das kleine Fluor-Atom ist so gut wie nicht polarisierbar.
Harte Säuren und Basen bestehen aus Teilchen, die nur recht schlecht polarisierbar sind. Das sind in der Regel kleine Moleküle oder Ionen mit einer hohen Ladungsdichte.
Weiche Säuren und Basen sind dagegen recht große Teilchen, deren Außenelektronen sich wegen der geringen Ladungsdichte leicht polarisieren lassen.
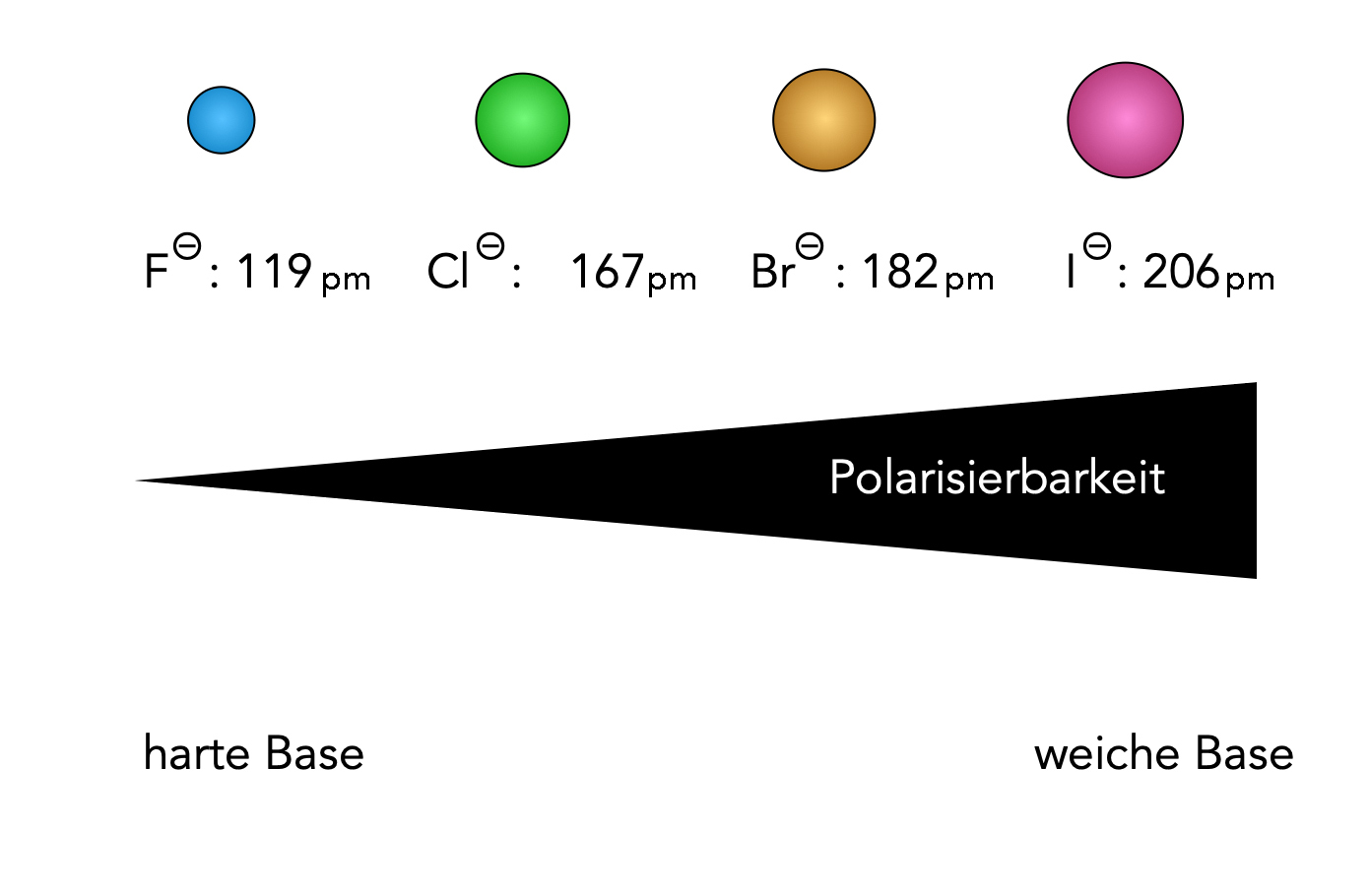
harte und weiche Halogenid-Basen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die obige Abbildung zeigt die Anionen der vier Halogene, ihre Ionenradien [1] sowie ihre Polarisierbarkeit. Fluorid und Chlorid gehören zu den harten Basen, Bromid und Iodid zu den weichen Basen.
Welchen Nutzen hat das HSAB-Konzept?
Die Einteilung der Lewis-Säuren und -Basen in harte und weiche ist ja ganz gut und schön, doch welchen Nutzen kann man aus diesem neuen Konzept eigentlich ziehen?
Pearson und weitere Menschen haben eine Faustregel formuliert, die ungefähr so lautet:
"Harte Basen reagieren bevorzugt mit harten Säuren zu stabilen Verbindungen, während weiche Basen bevorzugt mit weichen Säuren zu stabilen Verbindungen reagieren".
Nach Lewis ist das Proton als Säure anzusehen, da es ein leeres Orbital besitzt. Wegen des winzigen Radius und der dadurch bedingten hohen Ladungsdichte ist das Proton ganz klar eine extrem harte Lewis-Säure. Mit einer sehr harten Base wie dem Fluorid-Ion bildet das Proton dann eine sehr stabile Verbindung, nämlich Fluorwasserstoff, eine Brönsted-Säure.
Das Cadmium(II)-Ion Cd2+ ist dagegen eine weiche Lewis-Säure und sollte daher bevorzugt mit Bromid- oder Iodid-Ionen reagieren.
Weitere Beispiele für Säure-Base-Reaktionen nach Lewis [2]:
$(H_3C)_2O: + \circ BF_3 \to (H_3C)_2O-BF_3 $
Die harte Lewis-Base Dimethylether reagiert mit der harten Lewis-Säure Bortrifluorid zu einem stabilen Säure-Base-Komplex.
$(H_3C)_2S: + \circ BH_3 \to (H_3C)_2S-BH_3 $
Die weiche Lewis-Base Dimethylsulfid reagiert mit der weichen Lewis-Säure Borwasserstoff zu einem stabilen Säure-Base-Komplex.
Die Komplexe aus einer harten Base und einer weichen Säure (und umgekehrt) sind nicht so stabil wie die hart-hart-Komplexe.
Ein schönes Beispiel hierfür ist die folgende Reaktion [2]:
$ Al_2S_3 + 3 \ HgO \rightleftharpoons Al_2O_3 + 3 \ HgS$
Das Aluminiumsulfid Al2S3 ist eine Verbindung, die sich aus der harten Lewis-Base Al3+ und der weichen Lewis-Säure S2- zusammensetzt. Und auch das Quecksilberoxid HgO setzt sich aus der weichen Lewis-Säure Hg2+ und der starken Lewis-Base O2- zusammen.
Das Reaktionsprodukt Aluminiumoxid Al2O3 besteht aus der Kombination hart/hart, während das Reaktionsprodukt Quecksilbersulfid HgS aus der Kombination weich/weich besteht. Die Reaktionsprodukte sind also stabiler als die Ausgangsstoffe, und das ist auch der Grund dafür, dass diese Reaktion abläuft.
Mit dem HSAB-Konzept kann man also Vorhersagen über den Verlauf chemischer Reaktionen treffen und die unterschiedliche Stabilität verschiedener Komplexverbindungen erklären.
Hier noch ein Beispiel:
Das Ag+-Kation ist eine weiche Lewis-Säure (vier Elektronenschalen, aber nur eine positive Ladung, also geringe Ladungsdichte). Silber-Ionen bilden mit Halogenid-Ionen schwerlösliche Silberhalogenide. Das stabilste Silberhalogenid müsste entstehen, wenn Ag+-Kationen mit I-- oder Br--Ionen reagieren, denn dies sind weiche Lewis-Basen. Tatsächlich ist dies der Fall. Silberiodid und Silberbromid sind schwer wasserlöslich, die Bindung zwischen den beiden Atomen hat stark kovalenten Charakter, während Silberfluorid relativ gut wasserlöslich ist, die Ag-F-Bindung hat stark ionischen Charakter.
Auch die Halogenwasserstoffsäuren bestätigen die Richtigkeit der Faustregel (hart + hart bzw. weich + weich = stabiler Säure-Base-Komplex). Fluorwasserstoff besteht aus einer harten Säure und einer harten Base, Iodwasserstoff aus einer harten Säure und einer weichen Base. Die Verbindung HI ist instabiler als HF, und daher wird das H-Atom sehr leicht als Proton abgegeben. Der pKS-Wert von HI ist mit -10 deutlich negativer als der von HF mit +3 [3].
Das HSAB-Konzept hat aber auch Grenzen
Viele Phänomene wie die unterschiedliche Stabilität von Lewis-Säure-Base-Komplexen kann man gut mit dem HSAB-Konzept erklären. Aber der Einfluss der Härte einer Säure oder Base ist nicht der alleinige Faktor, der die Stabilität eines solchen Komplexes bestimmt, auch andere Faktoren spielen dabei eine wichtige Rolle. Beispielsweise die Hydrationsenthalpie der Komplex-Komponenten, wenn der Komplex wieder in die Lewis-Säure und die Lewis-Base zerfällt.
Natrium-Ionen beispielsweise sind harte Lewis-Säuren, und das OH--Ion ist eine harte Lewis-Base. Man sollte also erwarten, dass der Säure-Base-Komplex NaOH sehr stabil ist (hart + hart). Natriumhydroxid löst sich aber extrem gut in Wasser. Die Ursache hierfür ist die große Hydrationsenthalpie der OH--Ionen und der Na+-Ionen.
Beispiele von Lewis-Säuren
(Liste direkt aus der Wikipedia übernommen)
- Hart: H+; Li+; Na+; K+; Be2+; Mg2+; Ca2+; BF3; BCl3; Al3+; AlCl3; AlH3; Cr3+; Fe3+; Co3+; Ti4+; Cr6+; Mn2+; Ga3+
- Grenzbereich: B(CH3)3; Zn2+; Ni2+; Co2+; Fe2+; Cu2+; Pb2+; Rh3+; Ir3+; Ru3+
- Weich: Pt2+; Pt4+; Pd2+; Au+; Hg2+; Hg22+; Cd2+; Cu+; BH3; Ag+; Tl+; Ge2+; Rh+; Ir+; Ru2+.
Beispiele von Lewis-Basen
(Liste direkt aus der Wikipedia übernommen)
Quellen: