Erklärung der Versuchsergebnisse
Modellversuch
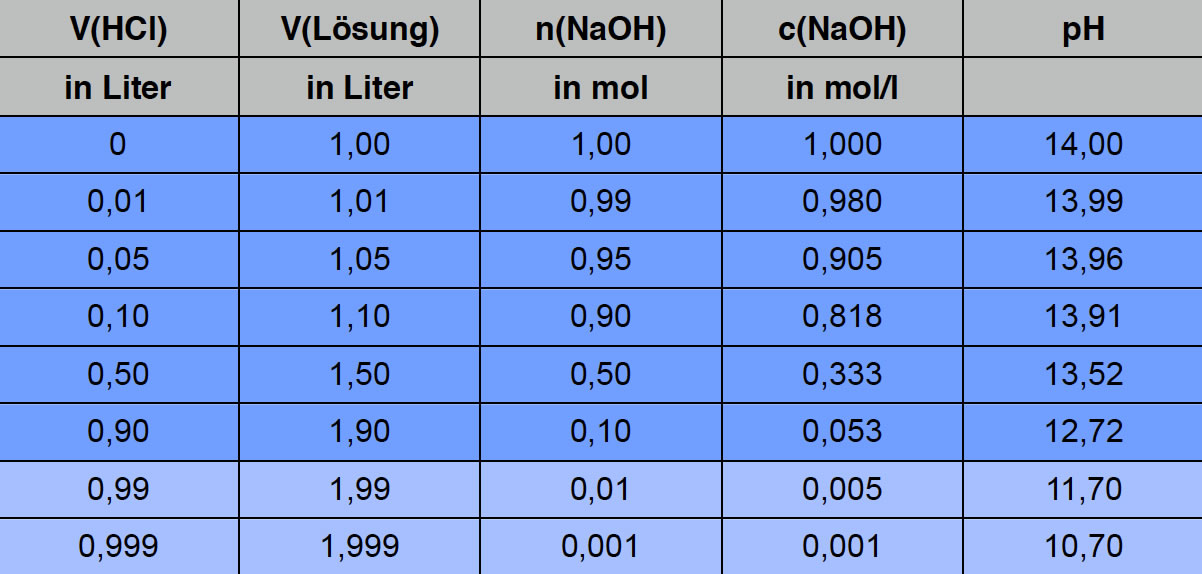
Hier sehen Sie die Simulation einer Titration. In diesem Modellversuch wurde 1 Liter Natronlauge der Konzentration c(NaOH) = 1 mol/l in ein großes Becherglas gegeben, und dann wird portionsweise Salzsäure der Konzentration c(HCl) = 1 mol/l dazugegeben.
In der linken Spalte sieht man das Volumen der zugegebenen HCl. Die zweite Spalte zeigt dann, wie das Gesamtvolumen der Lösung zunimmt (anfangs 1 Liter). In der dritten Spalte kann man sehen, dass die Stoffmenge n(NaOH) durch die Neutralisationsreaktion immer weiter abnimmt. Entsprechend nimmt auch c(NaOH) = n(NaOH)/V(Lösung) ab (vierte Spalte). Aus c(NaOH) kann man über das Ionenprodukt des Wassers schließlich den pH-Wert der Lösung berechnen (letzte Spalte).
Was hier auffällt: Der pH-Wert nimmt extrem langsam ab. Selbst nach Zugabe von 1/2 Liter Salzsäure hat sich der pH-Wert nicht nennenswert verändert, er ist von 14,00 auf 13,52 zurückgegangen, also um lediglich 0,48 Einheiten.
Der Grund hierfür ist die Tatsache, dass der pH-Wert ein logarithmisches Maß ist. Wenn sich c(NaOH) auf 1/10 des ursprünglichen Wertes verringert hat (nach Zugabe von ziemlich viel HCl), ist der pH-Wert nur um eine Einheit gesunken. Und hat sich c(NaOH) auf 1/1000 des Wertes verringert (nach Zugabe von fast 1 Liter HCl), ist der pH-Wert nur um gut drei Einheiten von 14,00 auf 10,70 gesunken.
Wenn man aber genau 1 Liter HCl zugegeben hat, liegt der pH-Wert schon bei 7. Wenige Tropfen HCl bewirken also ein Absinken des pH-Wertes von 10,7 auf 7,0 - und das ist der Grund, warum man bei einer Titration so leicht den Äquivalenzpunkt verpasst. Ein paar Tropfen mehr, und der pH-Wert liegt schon bei 4, wie die nächste Tabelle zeigt:
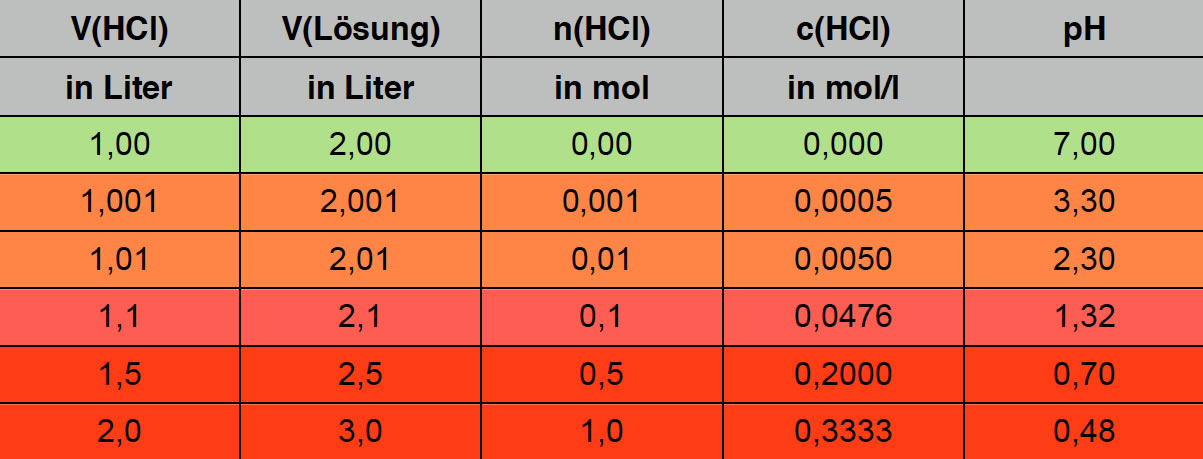
Ein einziger Milliliter HCl senkt den pH-Wert von 7 auf 3,3.
Trägt man die so erhaltenen pH-Werte (sei es durch Simulation gewonnen oder durch einen tatsächlichen Versuch) gegen die verbrauchte Salzsäure auf, so gewinnt man eine Titrationskurve:
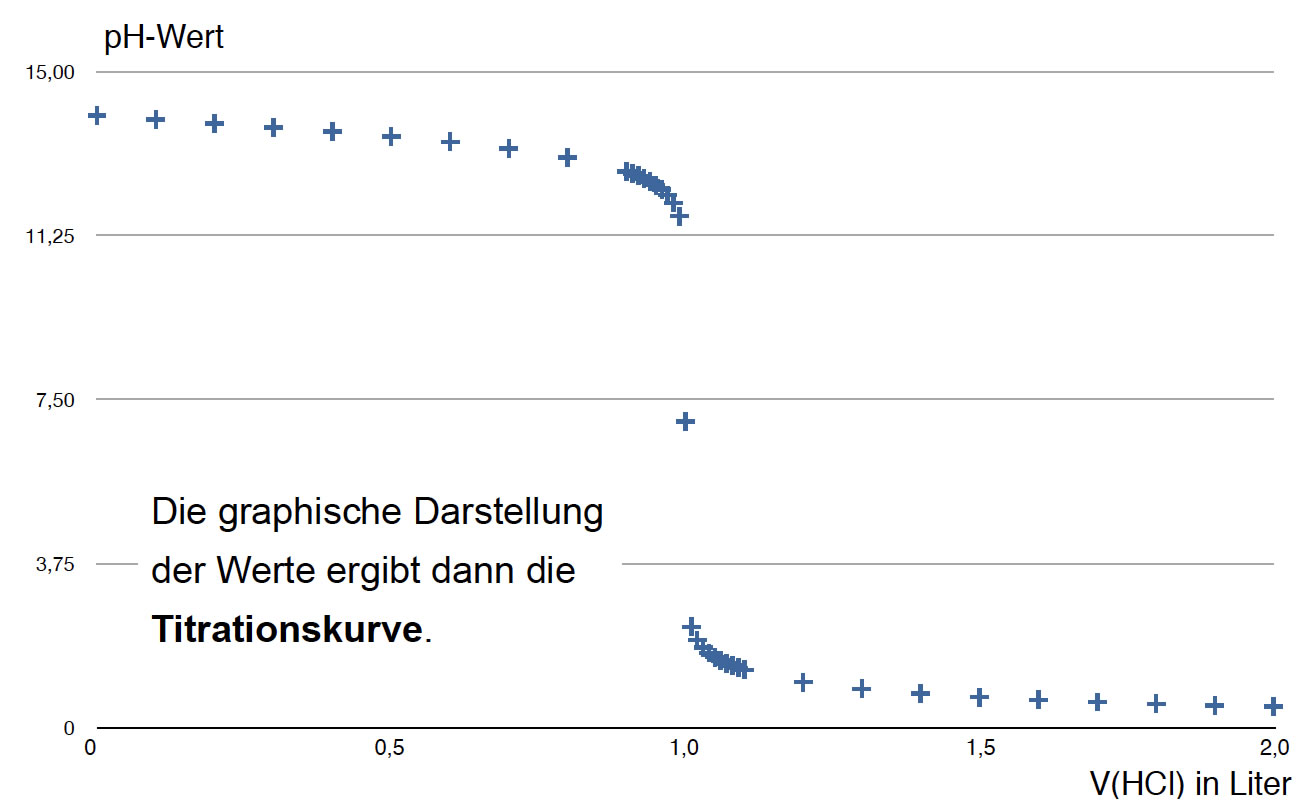
Hier sehen Sie die von einer Tabellenkalkulation nach obigem Verfahren ermittelte Titrationskurve.
Die Titration schwacher Säuren sowie die Titration zweiprotoniger Säuren liefern andere Titrationskurven. Dieses Thema habe ich auf eigenen Vertiefungsseiten (Leistungskurs) behandelt.
Für interessierte Schüler(innen) gibt es noch eine kleine Extraseite mit dem Titel "Berechnungen zur Titration starker Säuren bzw. Laugen".