Versuch zum pH-Wert
Den pH-Wert führt man am besten mit einem kleinen Versuch ein:
Versuch 6
pH-Werte verschiedener LösungenDurchführung:
Der pH-Wert von Salzsäure-Lösungen der Konzentration c(HCl) = 1 mol/l, 0,1 mol/l und 0,01 mol/l wird gemessen. Entsprechend wird der pH-Wert von Natronlaugen der Konzentrationen c(NaOH) = 1 mol/l, 0,1 mol und 0,01 verfahren.
Beobachtungen:
Bei den Säuren können pH-Werte von 0 (1 mol/l), 1 (0,1 mol/l) und 2 (0,01 mol/l) gemessen werden, bei den Laugen pH-Werte von 14 (1 mol/l), 13 (0,1 mol/l) sowie 12 (0,01 mol/l).
Wenn der Versuch korrekt durchgeführt wird, müssten bei den Säuren und Laugen die oben genannten pH-Werte gemessen werden. In der Praxis treten immer wieder durch Verdünnungs- oder andere Effekte bedingte Abweichungen auf, die uns aber nicht weiter stören sollen.
Allgemein wird der pH-Wert folgendermaßen definiert:
pH-Wert
Der pH-Wert ist der negative dekadische Logarithmus der Konzentration der Oxonium-Ionen.
Hat eine saure Lösung einen pH-Wert von 4, so enthält die Lösung 10-4 mol Oxonium-Ionen pro Liter. Bei einem pH-Wert von 7 beträgt die Konzentration der Oxonium-Ionen 10-7 mol/l. Und eine alkalische Lösung, deren pH-Wert 12 ist, enthält 10-12 mol Oxonium-Ionen in einem Liter. Das folgende Bild illustriert das Gesagte:

Mit der nächsten Abbildung kann man schön aufzeigen, dass der pH-Wert ein logarithmisches Maß ist
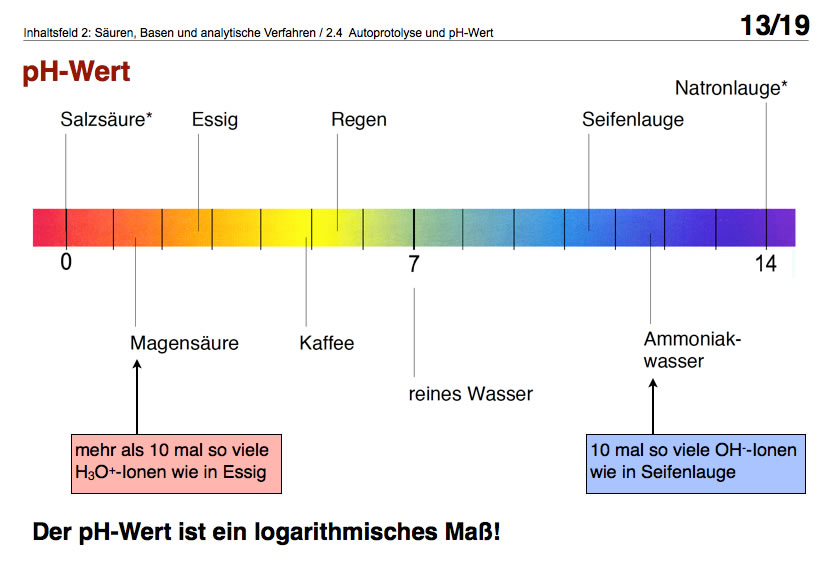
Obwohl sich Magensäure und Essig nur um ca. eine Einheit auf der pH-Skala unterscheiden, enthält Magensäure ca. 10 mal so viele Oxonium-Ionen wie Essig.
Temperaturabhängigkeit des pH-Wertes
Versuch 7
pH-Wert von heißem WasserBei diesem Versuch wird Wasser langsam erhitzt und dabei der pH-Wert beobachtet. Wenn der Versuch gut läuft, sinkt der pH-Wert langsam von 7 auf 6,5 oder noch weniger.
Reines Wasser hat bei Zimmertemperatur einen pH-Wert von 7, weil die Oxoniumionen-Konzentration den Wert von 10-7 mol/l hat. Erhitzt man Wasser, so verändert sich der pH-Wert in Bereiche unterhalb von 7.

100°C heißes Wasser hat zum Beispiel einen pH-Wert von 6,14. Also könnte man jetzt denken, dass kochendes Wasser sauer reagiert. Das ist aber nicht der Fall, denn auch kochendes Wasser enthält genau so viele Hydroxid-Ionen wie Oxonium-Ionen, während "sauer" immer heißt, dass ein Überschuss an Oxonium-Ionen vorhanden ist.
Wieso der pH-Wert von der Temperatur abhängt, hat etwas mit dem Prinzip des kleinsten Zwangs zu tun. Die Autoprotolyse ist die Rückreaktion einer Neutralisation. Bei einer Neutralisation wird bekanntlich Wärmeenergie freigesetzt, die Autoprotolyse ist dagegen eine endotherme Reaktion, verbraucht also Energie. Erhitzt man nun das Wasser, so wird Wärmeenergie zugeführt. Damit wird diejenige Reaktion begünstigt, die Wärme verbraucht, also die endotherme Autoprotolyse. Nach dem Prinzip des kleinsten Zwangs wirkt eine Reaktion durch Verschiebung des chemischen Gleichgewichts stets dem "Zwang" entgegen, der auf die Reaktion einwirkt. Hier wirkt Wärme auf die Reaktion ein, und durch die Begünstigung der endothermen Reaktion wird Wärme quasi verbraucht.