Einfluss des angreifenden Teilchens
Wenn das angreifende Teilchen ein starkes Nucleophil ist, dann wird grundsätzlich der Weg der Nucleophilen Substitution bevorzugt. Ist das angreifende Teilchen dagegen eine starke Base, erfolgt meistens eine Eliminierung als Hauptreaktion.
Bevor wir mit unseren Überlegungen weitermachen, wollen wir noch einmal den Unterschied zwischen einem Nucleophil und einer Base klären.
Die Begriffe Nucleophilie und Basizität
Eine starke Lewis-Base ist nicht automatisch ein starkes Nucleophil. Beide Begriffe, Nucleophilie und Basizität, bezeichnen unterschiedliche Aspekte. Während die Nucleophilie ein kinetisches Maß für die Geschwindigkeit ist, mit der ein Teilchen ein positives oder positiv polarisiertes C-Atom angreift, ist die Basizität eine thermodynamische Größe, welche die Lage des Gleichgewichts beschreibt, das sich ergibt, wenn ein Teilchen :B ein Proton anlagert.
$HB \rightleftharpoons H^{+} + :B^{-}$
Die Basizität einer Verbindung kann relativ leicht quantitativ gemessen werden und wird dann als pKB-Wert dargestellt. Die Nucleophile dagegen kann nicht so leicht quantitativ gemessen werden, die Nucleophilie hängt beispielsweise von der Art des Lösemittels ab, in der die Reaktion stattfindet. In einem polaren protischen Lösemittel kann die Reihenfolge der Nucleophile eine vollkommen andere sein als in einem polaren aprotischen Lösemittel.
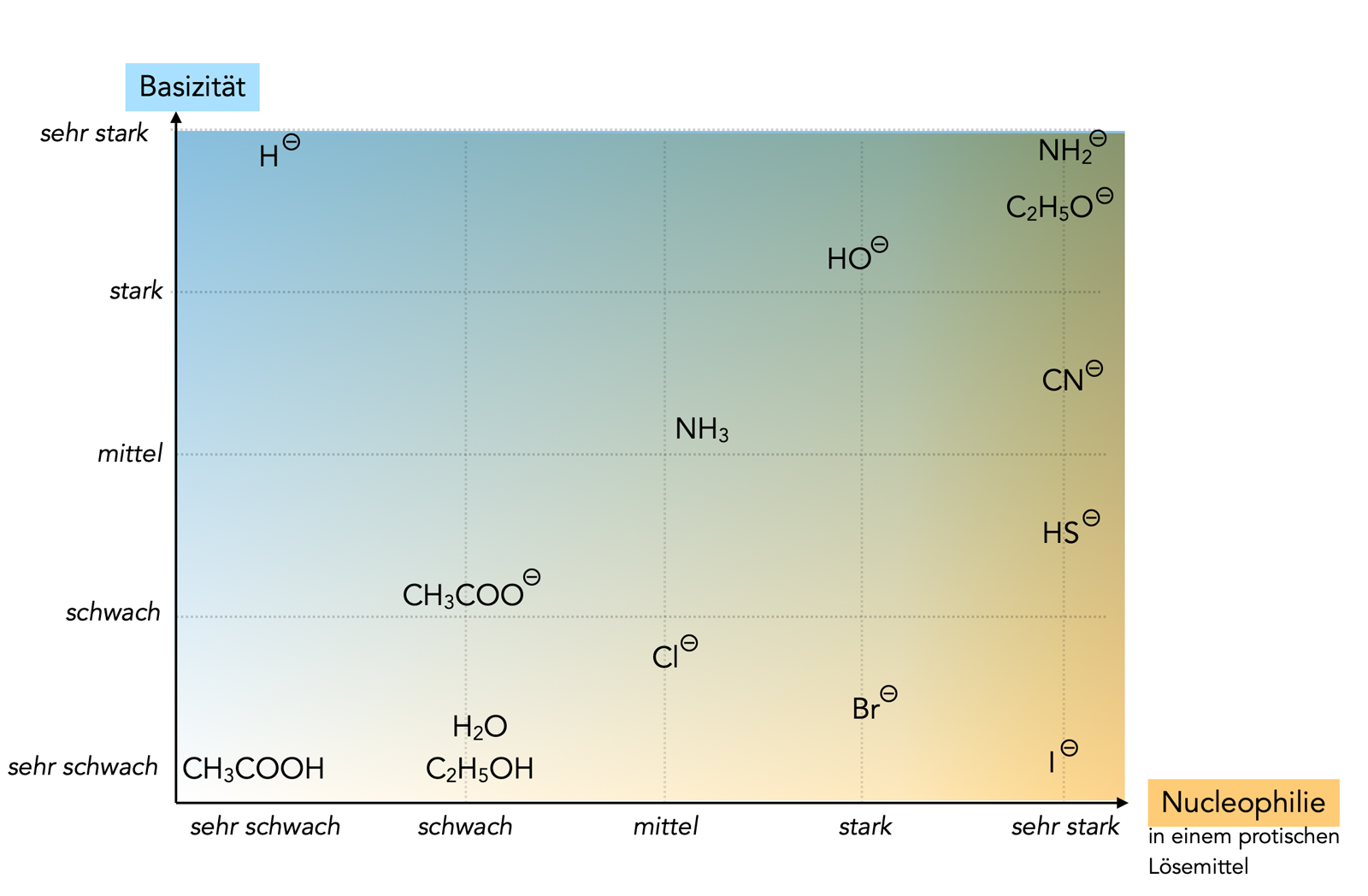
Basizität und Nucleophilie
Autor: Ulrich Helmich 07/2023, Lizenz: Public domain
Das obige Schema habe ich aus mehreren Quellen konstruiert. Die pKS-Werte der Basen finden sich auf der Wikipedia-Seite "Säurekonstante". Die Angaben zur Nucleophilie in einem protischen Lösemittel habe ich mir aus verschiedenen Quellen zusammengesucht.
Die Iod-Ion ist ein Beispiel für ein sehr starkes Nucleophil (protisches Lösemittel!), gleichzeitig ist das Iod-Ion eine sehr schwache Brönsted-Base. Ein primäres Halogenalkan würde also eher in einer SN2-Reaktion mit Iodid reagieren als eine Eliminierungsreaktion eingehen, die Base :I- schafft es nicht, ein Proton aus dem Halogenalkan zu abstrahieren.
Das Hydroxid-Ion ist ein starkes Nucleophil und gleichzeitig eine starke Base. In diesem Falle hängt es vom Bau des Halogenalkans ab, ob eher eine SN2-Reaktion stattfindet oder eine E2-Eliminierung. Kann das Halogen-Atom leicht von hinten angegriffen werden (keine sterische Hinderung), ist die Substitution wahrscheinlicher. Kann eines der Protonen leicht abstrahiert werden und ist das Halogen-Atom nicht so leicht zugänglich, spricht das eher für eine Eliminierung.
E2 erfolgt meistens als trans-Eliminierung
Schauen wir uns mal folgende Situation an:
Sorry, die Seite ist noch in Arbeit...
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Carey, Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- Klein, Wiley Schnellkurs Organische Chemie II - Reaktionen, Weinheim 2021.