Alkane sind reaktionsträge Verbindungen. Typisch sind nur radikalische Substitutionen, Oxidationen und thermisch erzwungene Umsetzungen wie Cracken oder Isomerisierung.
Die radikalische Substitution wurde auf einer eigenen Seite ausführlich beschrieben, auf dieser Seite wollen wir noch kurz auf die Oxidation sowie thermisch erzwungene Dehydrierungen und Isomerisierungen etc. eingehen, wie sie zum Beispiel beim Cracken von Erdöl stattfinden.Oxidation
Aus dem Alltag ist die Oxidation der Alkane nicht wegzudenken, schließlich ist es die Reaktion, die in jedem Verbrennungsmotor und in jeder Heizungsanlage abläuft, wenn sie mit Erdöl oder Erdgas betrieben wird. So allgegenwärtig diese Reaktion ist, so ist ihr Mechanismus doch noch weitgehend ungeklärt. Fest steht wohl, dass es sich um eine radikalische Reaktion handelt, die einerseits durch eine hohe Aktivierungsenergie (Erzeugung der Radikale) gekennzeichnet ist, andererseits durch eine hohe Reaktionsenthalpie.
Reaktionsgleichung der Oxidation
Hier sehen wir die allgemeine Reaktionsgleichung der vollständigen Oxidation:
$C_{n}H_{2n+2} + \frac{3n+1}{2}O_{2} \to n \ CO_{2} + (n+1) \ H_{2}O + \Delta H$
Das wollen wir doch gleich mal ausprobieren. Die Verbrennung von Propan läuft dann nach dieser Gleichung ab:
$C_{3}H_{8} + 5 \ O_{2} \to 3 \ CO_{2} + 4 \ H_{2}O + \Delta H$
Reaktionsmechanismus der Oxidation
Bei der Oxidation der Alkane handelt es sich allem Anschein nach um eine radikalische Kettenreaktion, deren genauer Mechanismus aber noch weitgehend ungeklärt ist. Nach der Dissertation von Crina I. Heghes (Heidelberg, September 2006) besteht der Mechanismus der Verbrennung niedriger Alkane (Methan, Ethan, Propan und Butan) aus 412 Elementarreaktionen und enthält 61 verschiedene Edukte, Zwischenprodukte und Produkte. Der erste Schritt bei der Verbrennung von Methan ist die Abspaltung eines H-Atoms, wobei ein $\bullet CH_{3}$-Radikal entsteht. Eingeleitet wird dieser Schritt durch andere Radikale wie $\bullet O$ , $\bullet H$ oder $\bullet OH$. Hier sehen Sie eine dieser Startreaktionen:
$CH_{4} +\bullet OH \to \bullet CH_{3} + H_{2}O$
Weiter möchte ich an dieser Stelle nicht auf den Reaktionsmechanismus der Oxidation von Alkanen eingehen.
Dehydrierung
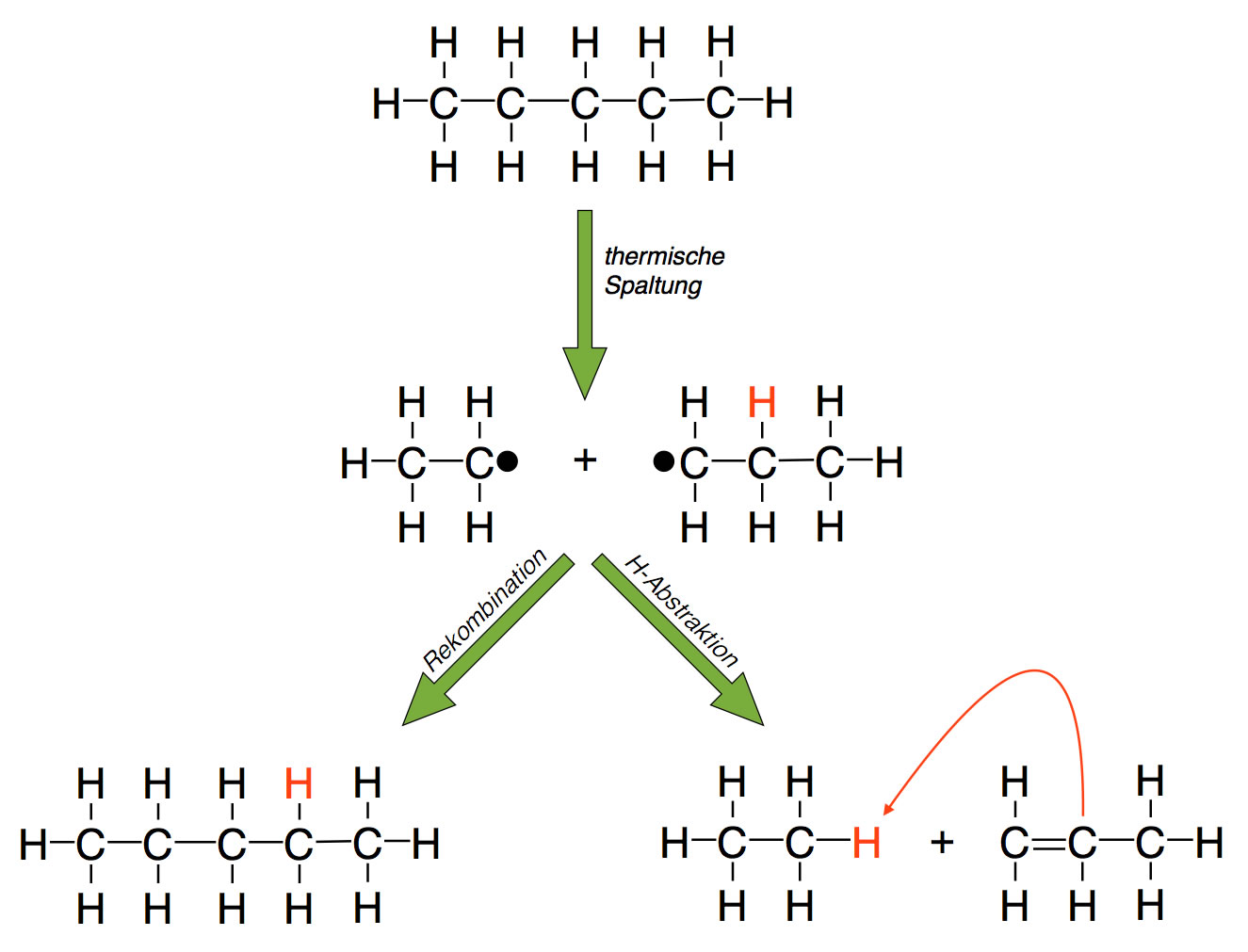
Durch den Entzug von Wasserstoff kann man aus Alkanen Vertreter der Stoffklasse der Alkene gewinnen. Das soll hier einmal am Beispiel der Pyrolyse von Pentan gezeigt werden.
Bei der sogenannten Pyrolyse werden Alkane unter Einwirkung eines Katalysators (Zeolith) erhitzt, dabei bilden sich kürzere Alkylradikale. Solche Alkylradikale haben zwei Möglichkeiten, miteinander zu reagieren. Zunächst einmal kann sich ein neues, größeres Alkan aus zwei dieser Radikale bilden (linker Reaktionsweg). Zum andern kann ein Radikal ein H-Atom homolytisch abspalten und auf das andere Radikal übertragen (Wasserstoff-Abstraktion). So entstehen ein Alkan und ein Alken (rechter Reaktionsweg). Beim thermischen Cracken laufen übrigens ähnliche Prozesse ab: Lange Alkane werden durch hohe Temperaturen in kurze Alkylradikale gespalten, die dann auf die oben gezeigte Weise zu kürzeren Alkanen oder Alkenen reagieren. Natürlich entstehen dabei durch Rekombination von Radikalen auch wieder Moleküle längerer Alkane, aber diese können dann wieder durch die hohe Temperatur in zwei neue Alkylradikale gespalten werden.
Quellen:
- Fox, M. A.; Whitesell, J. K.: Organische Chemie – Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage. Heidelberg: Spektrum Akademischer Verlag, 1995.
- Vollhardt, K. P. C.; Schore, N. E.: Organische Chemie. 6. Auflage. Weinheim: Wiley-VCH, 2020.