Stickstoffoxide und die Rolle des Drucks
In fast allen Schulbüchern wird das Prinzip des kleinsten Zwangs (Prinzip von Le Chatelier, nach dem französischen Entdecker benannt) am Beispiel der Zersetzung von Stickoxiden eingeführt. Darum möchte ich auch auf dieser Webseite darauf eingehen, vor allem, weil das Beispiel wirklich sehr anschaulich ist.
Schauen wir uns zunächst die Reaktion an, um die es geht:
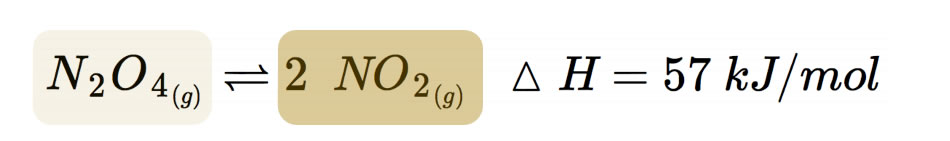
Aus N2O4 (farblos) bilden sich 2 NO2 (braun)
Farbloses Distickstofftetraoxid zerfällt in einer monomolekularen Gleichgewichtsreaktion zu tiefbraunem Stickstoffdioxid.
Aus einem Molekül entstehen also zwei Moleküle, aus 1 Mol N2O4 entstehen 2 Mol NO2.
Die Umkehrreaktion ist dagegen bimolekular; zwei NO2-Moleküle müssen zusammenstoßen, damit sich ein N2O4-Molekül bilden kann.
Was passiert nun, wenn man diese Reaktion in einem abgeschlossenen Gefäß ablaufen lässt?
Bildung eines chemischen Gleichgewichts
Die N2O4-Moleküle verteilen sich gleichmäßig im Reaktionsgefäß, sie prallen gegen die Wände des Gefäßes und üben einen gewissen Druck auf diese Wände aus. Und einige dieser Moleküle zerfallen entsprechend der obigen Reaktionsgleichung zu NO2.
Im Laufe der Zeit entsteht immer mehr NO2, während sich die Anzahl der N2O4-Moleküle verringert.
Da ein N2O4-Molekül in zwei NO2-Moleküle zerfällt, erhöht sich auch die Anzahl der Moleküle, die gegen die Wände des Gefäßes prallen. Der Druck in dem Gefäß nimmt zu.
Je mehr NO2 entsteht, desto größer ist auch die Wahrscheinlichkeit, dass zwei dieser NO2-Moleküle zusammenstoßen und wieder ein N2O4-Molekül bilden. Die Rückreaktion kommt in Gang. Irgendwann ist die Geschwindigkeit der Rückreaktion genau so groß wie die der Hinreaktion, und ein chemisches Gleichgewicht ist erreicht.
Aber das alles sollte Ihnen ja von den vorherigen Seiten einigermaßen bekannt sein. Die Frage, die sich jetzt stellt, ist die: Wie kann man durch Anwendung äußerer Faktoren die Lage dieses Gleichgewichts verändern?
Erhöhung des Druckes
Erhöhen wir doch einfach mal den Druck in dem Reaktionsgefäß. Dazu könnte man beispielsweise das N2O4, also den Ausgangsstoff, in einen Kolbenprober geben und warten, bis sich das chemische Gleichgewicht zwischen N2O4 und NO2 eingestellt hat. Der Kolbeninhalt ist dann hellbraun gefärbt (Mischung aus dem farblosen N2O4 und dem braunen NO2).
Nun schieben wir den Kolben zur Hälfte in den Mantel . Der Druck auf die Moleküle ist dann plötzlich doppelt so groß wie vorher, weil ja nur noch die Hälfte des Raumes zur Verfügung steht.
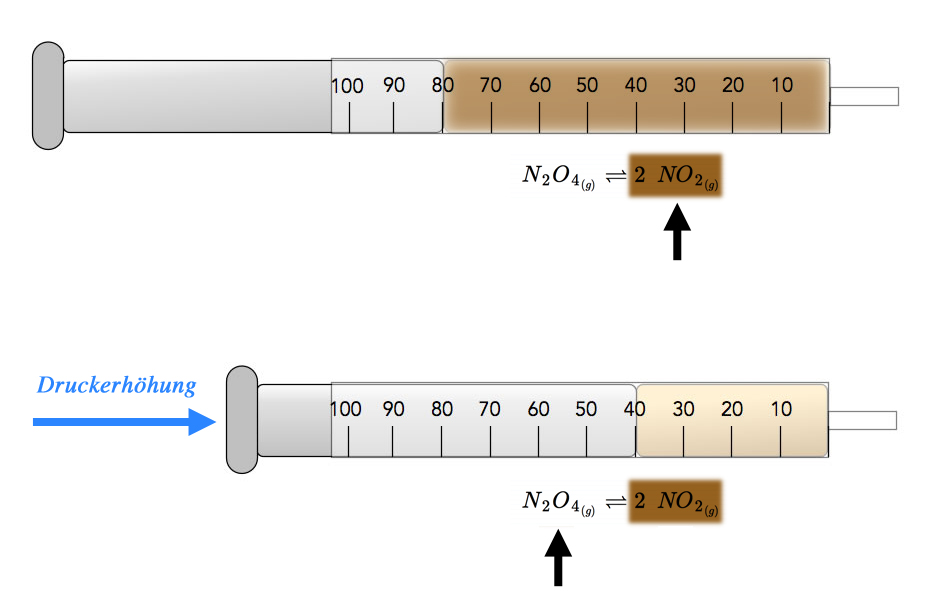
Das Gasvolumen im Kolbenprober wird auf die Hälfte reduziert
Ein herzlicher Dank geht an Holger Kest, der mich auf einen Fehler in der ursprünglichen Abbildung aufmerksam gemacht hat.
Durch diesen doppelten Druck auf die Teilchen steigt die Wahrscheinlichkeit einer Rückreaktion. Denn wenn aus zwei Molekülen ein neues Molekül wird, verringert sich die Zahl der Teilchen, und der Druck im Kolben sinkt. Damit wird dem erhöhten Druck entgegengewirkt.
Beobachten kann man bei dieser Druckerhöhung ein Hellerwerden des gasförmigen Kolbeninhalts. Denn das Gleichgewicht verschiebt sich durch den äußeren Zwang jetzt in Richtung N2O4, und dieses Gas ist ja farblos. Mit steigendem N2O4-Anteil wird der Kolbeninhalt also heller.
Der erhöhte Druck wirkt wie ein "Zwang" auf das System aus Edukten und Produkten. Das System weicht diesem Zwang aus, indem die Rückreaktion gefördert und die Hinreaktion gebremst wird. Das chemische Gleichgewicht verschiebt sich durch diesen äußeren Zwang weiter auf die linke Seite.
Reaktionen, bei denen gasförmige Edukte entstehen oder bei denen die Stoffmenge gasförmiger Teilchen erhöht wird, können durch Druckerhöhung oder -verminderung gesteuert werden. Eine Druckerhöhung verlagert das Gleichgewicht auf die linke Seite, eine Druckverminderung auf die rechte Seite.
Ein weiteres Beispiel für die Rolle des Drucks auf den Ablauf einer chemischen Reaktion ist die Ammoniak-Synthese aus Wasserstoff und Stickstoff.
Stickstoffoxide und die Rolle der Temperatur
Jetzt wird es etwas komplizierter. Sie kennen doch sicherlich den Unterschied zwischen endothermen und exothermen Reaktionen. Bei exothermen Reaktionen, zum Beispiel bei der Verbrennung von Magnesium an der Luft, muss nur wenig Aktivierungsenergie aufgewandt werden, aber wenn die Reaktion erst mal in Gang gekommen ist, wird jede Menge Reaktionsenergie freigesetzt. Bei endothermen Reaktion muss dagegen recht viel Aktivierungsenergie aufgewandt werden, und während der eigentlichen Reaktion wird nur ein Teil dieser investierten Energie wieder an die Umgebung abgegeben. Aber das ist Ihnen ja sicherlich alles bekannt.
Die Zersetzung von Distickstofftetraoxid ist eine endotherme Reaktion. Wie wirkt sich nun eine Erhöhung der Temperatur oder eine Absenkung der Temperatur auf eine solche endotherme Reaktion aus?
Wir überlegen wieder einmal streng logisch. Bei einer endothermen Reaktion muss Energie zugeführt werden, damit sie stattfindet. Man könnte die Reaktionsgleichung auch so formulieren:
$Energie$ $+ \ N_{2}O_{4_{(g)}} \rightleftharpoons 2 \ NO_{2_{(g)}}$
Die Energie wird hier quasi als Edukt interpretiert, das ist zwar nicht besonders professionell, hilft aber beim Verstehen. Wenn jetzt also Energie (zum Beispiel in Form von Wärme) zugeführt wird, ist das so, als ob man eine Edukt-Konzentration erhöhen würde. Das Gleichgewicht der Reaktion wird dann nach rechts verschoben. Und genau so ist es bei endothermen Reaktionen:
Bei endothermen Reaktionen wird das Gleichgewicht durch eine Temperaturerhöhung nach rechts verschoben, durch eine Temperaturerniedrigung dagegen nach links.
Was für endotherme Reaktionen gilt, gilt in umgekehrter Weise auch für exotherme Reaktionen:
Bei exothermen Reaktionen wird das Gleichgewicht durch eine Temperaturerhöhung nach links verschoben, durch eine Temperaturerniedrigung dagegen nach rechts.
Anschaulich kann man sich das so vorstellen: Wenn es einer exothermen Reaktion "zu kalt" wird (Temperaturerniedrigung), dann versucht sie diesem Zwang auszuweichen, indem sie Wärme produziert, also indem sie vermehrt Produkte herstellt.
Ein weiteres Beispiel für die Rolle der Temperatur auf den Ablauf einer chemischen Reaktion ist ebenfalls die Ammoniak-Synthese aus Wasserstoff und Stickstoff.
Die Temperatur kann auch indirekt auf das chemische Gleichgewicht wirken. Ein gutes Beispiel ist hierfür die Kesselstein-Bildung. Bei hohen Temperaturen lösen sich weniger Gase im Wasser, so dass eine Temperatur-Erhöhung die Konzentrationen von Edukten oder Produkten verändern kann, was sich wiederum auf die Lage des Gleichgewichts auswirkt.
Die Rolle der Konzentrationen
Betrachten wir wieder einmal die Herstellung eines Esters aus einer Carbonsäure und einem Alkohol. Die Gleichgewichtskonstante für die Synthese von Essigsäure-ethylester hatte den Wert 4,12. Hier noch einmal die Reaktionsgleichung:
$Essigsäure + Ethanol \rightarrow Essigsäure-ethylester + Wasser$
und hier das Massenwirkungsgesetz für die Estersynthese:
$K=\frac{c(Ester)*c(Wasser)}{c(Essigsäure)*c(Ethanol)}=4,12$
Was müssen wir nun machen, wenn wir die Ausbeute an Ester erhöhen wollen? Wenn wir je 1 mol Edukte einsetzen, erhalten wir ja nur 0,67 mol Ester und 0,67 mol Wasser. Es gibt hier vier Möglichkeiten, wie man die Produktausbeute (Ester) erhöhen könnte:
Größere Ausgangskonzentration von Essigsäure
Dadurch steigt die Wahrscheinlichkeit, dass ein Ethanol-Molekül mit einem Essigsäure-Molekül zusammenstößt. Die Geschwindigkeit der Hinreaktion nimmt zu, das Gleichgewicht wird zur Produktseite (rechts) verschoben.
Größere Ausgangskonzentration von Ethanol
Dadurch steigt die Wahrscheinlichkeit, dass ein Essigsäure-Molekül mit einem Ethanol-Molekül zusammenstößt. Die Geschwindigkeit der Hinreaktion nimmt zu, das Gleichgewicht wird zur Produktseite (rechts) verschoben.
Entnahme von Ester aus dem Reaktionsgemisch
Das Reaktionsgemisch besteht aus Ethanol, Essigsäure, Essigsäure-ethylester und Wasser. Essigsäure und Wasser haben recht hohe Siedepunkte, die Siedepunkt von Ethanol und dem Reaktionsprodukt Essigsäure-ethylester liegen sehr nah zusammen, nämlich bei 78,3 ºC bzw. 77,0 ºC. Man wird es also nicht schaffen, das Reaktionsprodukt durch Destillation vom Reaktionsgemisch abzutrennen. Angenommen, es ginge doch, dann würde man c(Ester) in dem Stoffgemisch verringern. Dadurch würde die Wahrscheinlichkeit sinken, dass ein Ester-Molekül mit einem Wasser-Molekül zusammenstößt. Die Rückreaktion würde dadurch behindert, und das Gleichgewicht der Reaktion würde auf die Produktseite verschoben.
Entnahme von Wasser aus dem Reaktionsgemisch
Es gibt zahlreiche wasserbindende Chemikalien, die man dem Stoffgemisch zusetzen könnte, zum Beispiel wasserfreies Kupfersulfat. Dadurch könnte man die Konzentration von Wasser im Stoffgemisch ständig niedrig halten. Die Wahrscheinlichkeit eines Zusammenstoßes zwischen einem Ester-Molekül und einem Wasser-Moleküle würde dadurch verringert, die Rückreaktion würde gehemmt, und das chemische Gleichgewicht würde auf die Produktseite verschoben.
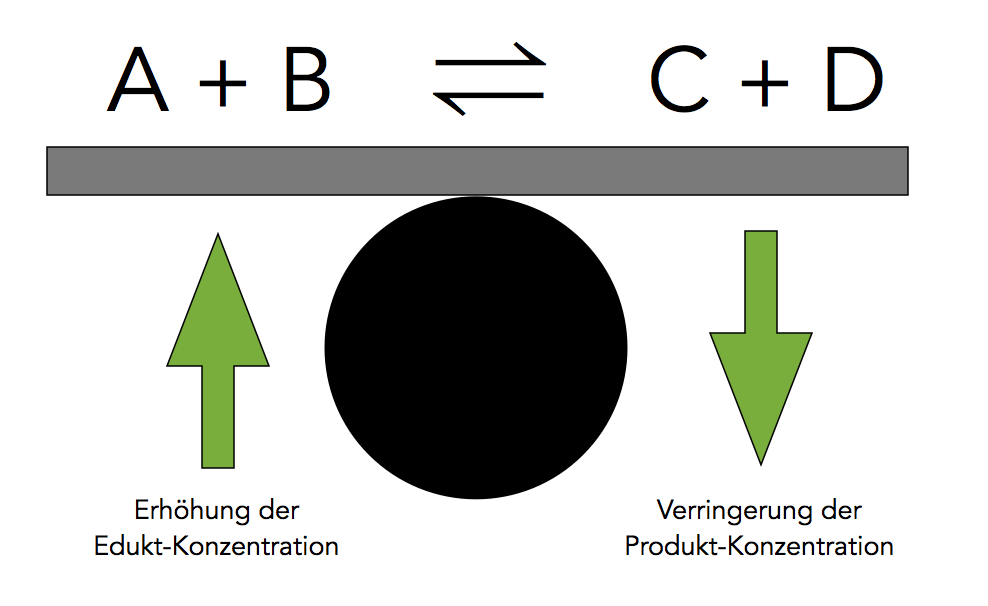
Anschauliche Darstellung der Konzentrationsabhängigkeit des chemischen Gleichgewichts
Wie man auf dem Bild 2 gut erkennen kann, führt die Erhöhung der Edukt-Konzentration zu einer Verschiebung des chemischen Gleichgewichts nach rechts, auf die Produktseite. Eine Verringerung der Produkt-Konzentration hat das selbe Ergebnis.
Ein weiteres Beispiel für die Rolle der Stoffkonzentrationen auf den Ablauf einer chemischen Reaktion ist wieder mal die Ammoniak-Synthese aus Wasserstoff und Stickstoff. Ein zweites Beispiel auf dieser Homepage ist die Bildung von Kesselstein.