Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- wissen, was man unter Entropie allgemein versteht,
- wissen, wie die Geschwindigkeit einer Reaktion von dem Entropie-Faktor abhängt.
- an drei Beispielen erläutern können, welchen Einfluss die Entropie auf die Reaktionsgeschwindigkeit hat.
Unter der Entropie versteht man ein Maß für die Unordnung eines Systems. Je größer die Unordnung, desto entropiereicher ist das System. Feststoffe, Kristalle etc. besitzen zum Beispiel nur sehr wenig Entropie, weil sie ja in hochgeordneten Strukturen vorliegen. Flüssigkeit, Lösungen etc. besitzen schon sehr viel mehr Entropie, und Gase schließlich sind extrem entropiereich.
Wenn bei einer chemischen Reaktion die Entropie zunimmt, ist das eine ziemlich starke Triebkraft für die Reaktion. Die Heftigkeit von Explosionen erklärt sich zumindest teilweise aus der starken Entropiezunahme: Aus Feststoffen wie Dynamit werden Gase wie CO2, Stickoxide etc.
Aber man muss gar nicht solche extremen Reaktionen in Betracht ziehen, es geht auch einfacher. Wenn Sie Kochsalz in Wasser auflösen, läuft dieser Vorgang freiwillig ab, Sie müssen keinen Bunsenbrenner aus dem Schrank holen, um den Prozess in Gang zu setzen. Warum ist das so? Weil bei dem Auflösen eines Salzes in Wasser die Entropie zunimmt. Im Salzkristall herrscht eine sehr große Ordnung, die Kationen und Anionen sitzen fest auf ihren Gitterplätzen. In der Lösung dagegen herrscht eine hohe Unordnung, die hydratisierten Salz-Ionen schwimmen wild durcheinander. Diese Entropie-Zunahme ist die entscheidende Triebkraft für das Lösen des Salzes.
Was hat nun die Entropie mit der Reaktionsgeschwindigkeit zu tun? In dem neuen Lehninger "Priciples of Biochemistry" von 2021, einem der Standardwerke der Biochemie, findet sich ein tolles Beispiel, das den Zusammenhang zwischen Reaktionsgeschwindigkeit und Entropie sehr gut erklärt. Ich habe mal versucht, dieses Beispiel mit Hilfe des schönen Molekülbau-Programms Avogadro.app zu verdeutlichen.
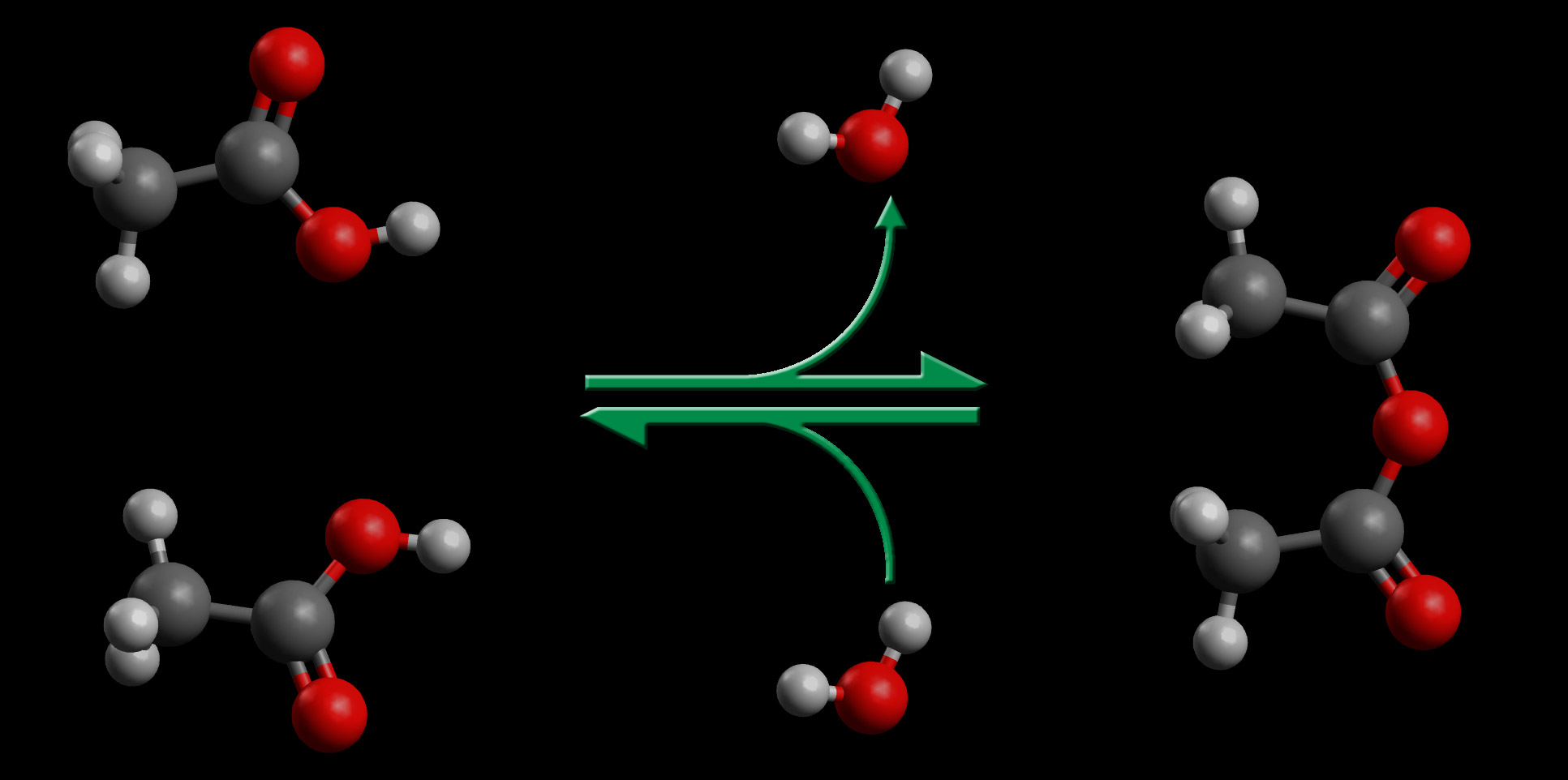
Reaktionsgeschwindigkeit und Entropie, Reaktion 1
Autor: Ulrich Helmich, Lizenz: Public domain
Auf dem ersten Bild sehen wir zwei Essigsäure-Moleküle, die unter Wasser-Abgabe zu einem Anhydrid-Molekül reagieren. Die Geschwindigkeit der Hin-Reaktion legen wir willkürlich auf den Wert 1 fest.
Reaktionsgeschwindigkeit und Entropie, Reaktion 2
Autor: Ulrich Helmich, Lizenz: Public domain
Auf dem zweiten Bild haben wir eine ähnliche Reaktion, allerdings sind die beiden Essigsäure-Moleküle sozusagen miteinander verbunden zu einem Butandisäure-Molekül; der Trivialname ist vielleicht bekannter: Bernsteinsäure. Die Hinreaktion läuft jetzt zehntausend mal schneller ab als bei der Reaktion 1. Auf die Erklärung hierfür müssten Sie eigentlich schon selbst kommen. Wenn zwei einzelne frei bewegliche Essigsäure-Moleküle miteinander reagieren, müssen sie mit einer gewissen Mindestgeschwindigkeit zusammenstoßen. Viel wichtiger ist aber, dass sie auch in einer bestimmten Orientierung zusammenstoßen müssen.
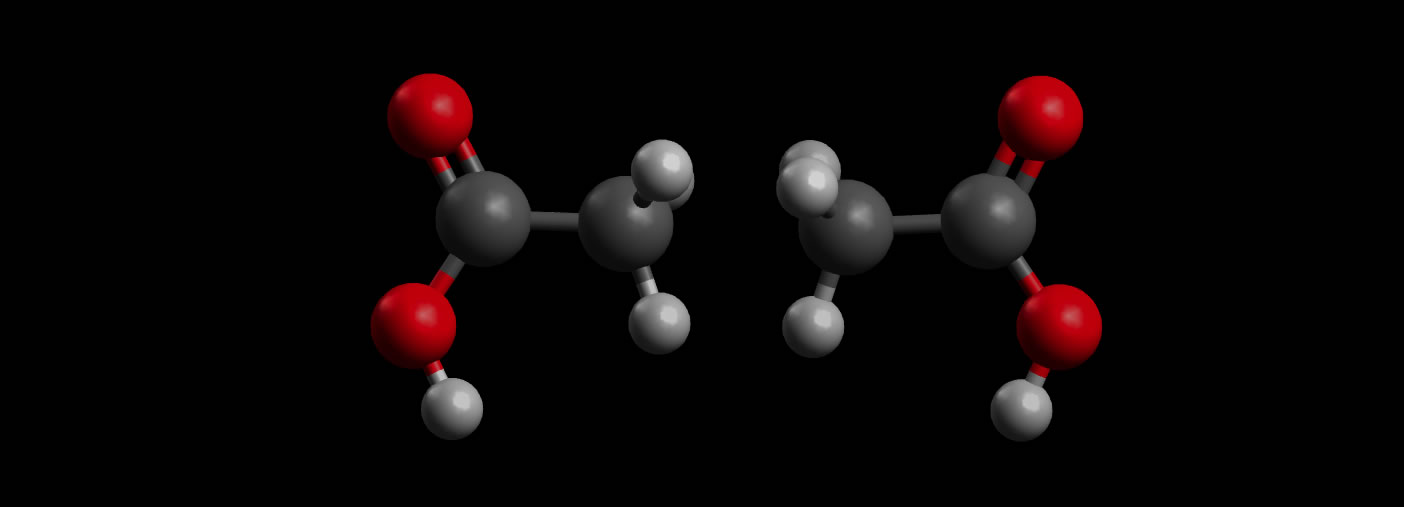
Ein erfolgloser Zusammenstoß von zwei Essigsäure-Molekülen
Autor: Ulrich Helmich, Lizenz: Public domain
Wenn die beiden Moleküle beim Zusammenstoß so orientiert sind, dass beispielsweise die beiden Methylgruppen aufeinander prallen, dann passiert nichts. Der Stoß ist nicht erfolgreich, wie man sagt.
In dem Bernsteinsäure-Molekül befinden sich die beiden Carboxygruppen aber schon in der richtigen Orientierung. Die Wahrscheinlichkeit eines "Zusammenstoßes" dieser beiden Gruppen wird durch diese hohe Ordnung bzw. geringe Entropie stark erhöht.
Allerdings können sich die beiden COOH-Gruppen noch frei im Molekül drehen, denn sie sind ja durch eine Einfachbindung mit dem Rest des Moleküls verbunden. Auch um die mittlere C-C-Einfachbindung besteht eine freie Drehbarkeit. Das heißt, es herrscht immer noch ein gewisses Maß an Entropie in den Molekülen:
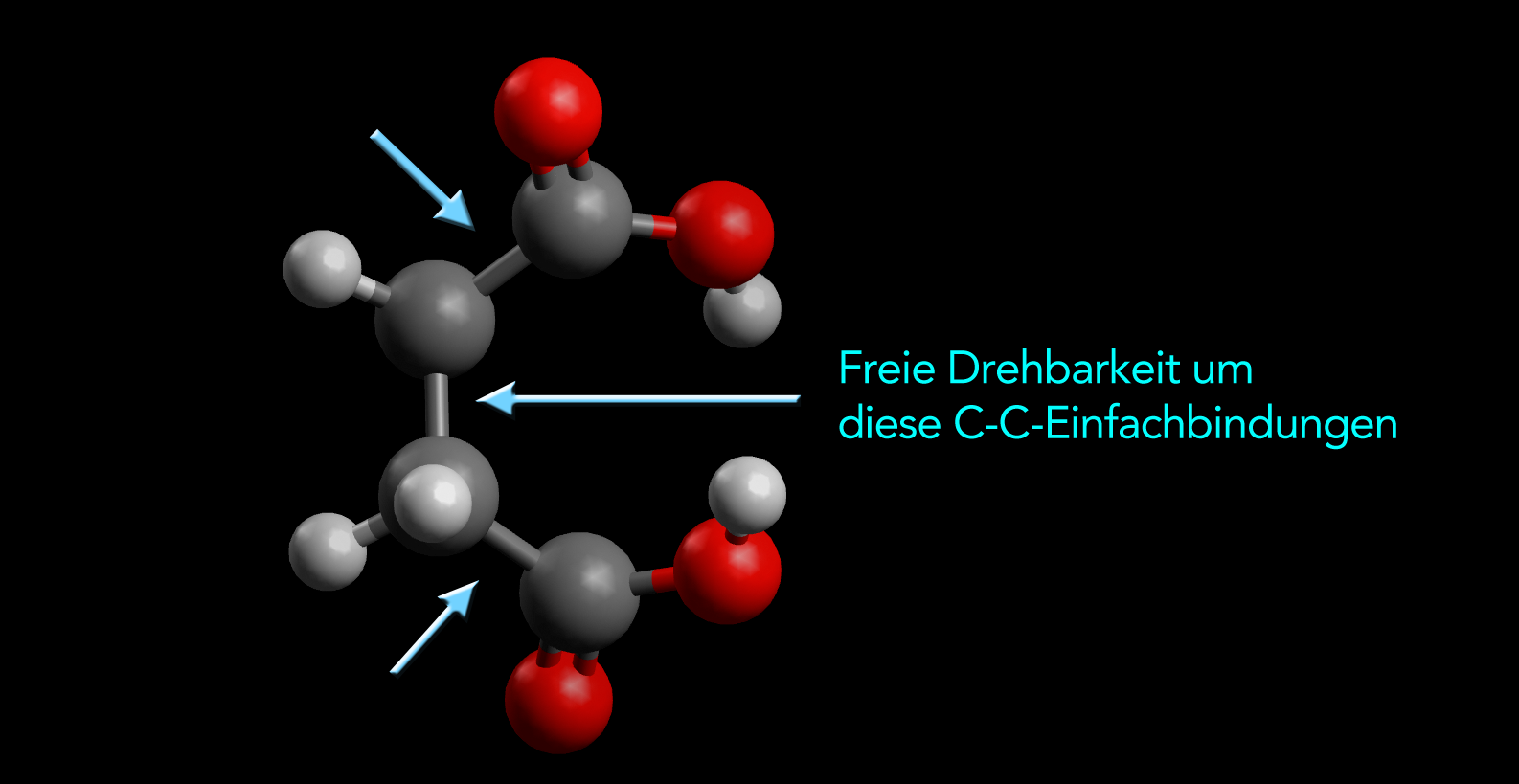
Freie Drehbarkeit um die Einfachbindungen
Autor: Ulrich Helmich, Lizenz: Public domain
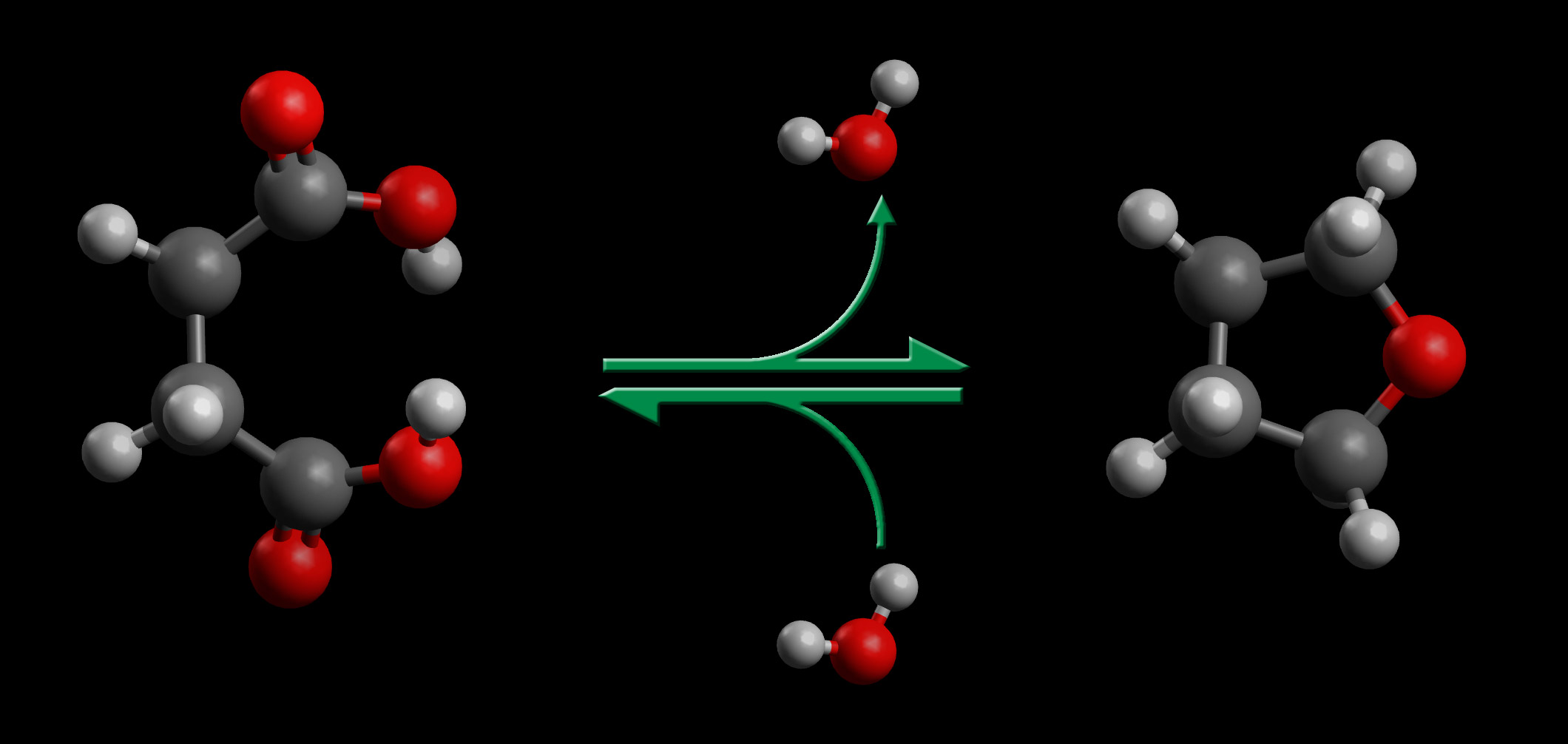
Beim nächsten Beispiel ist das anders:
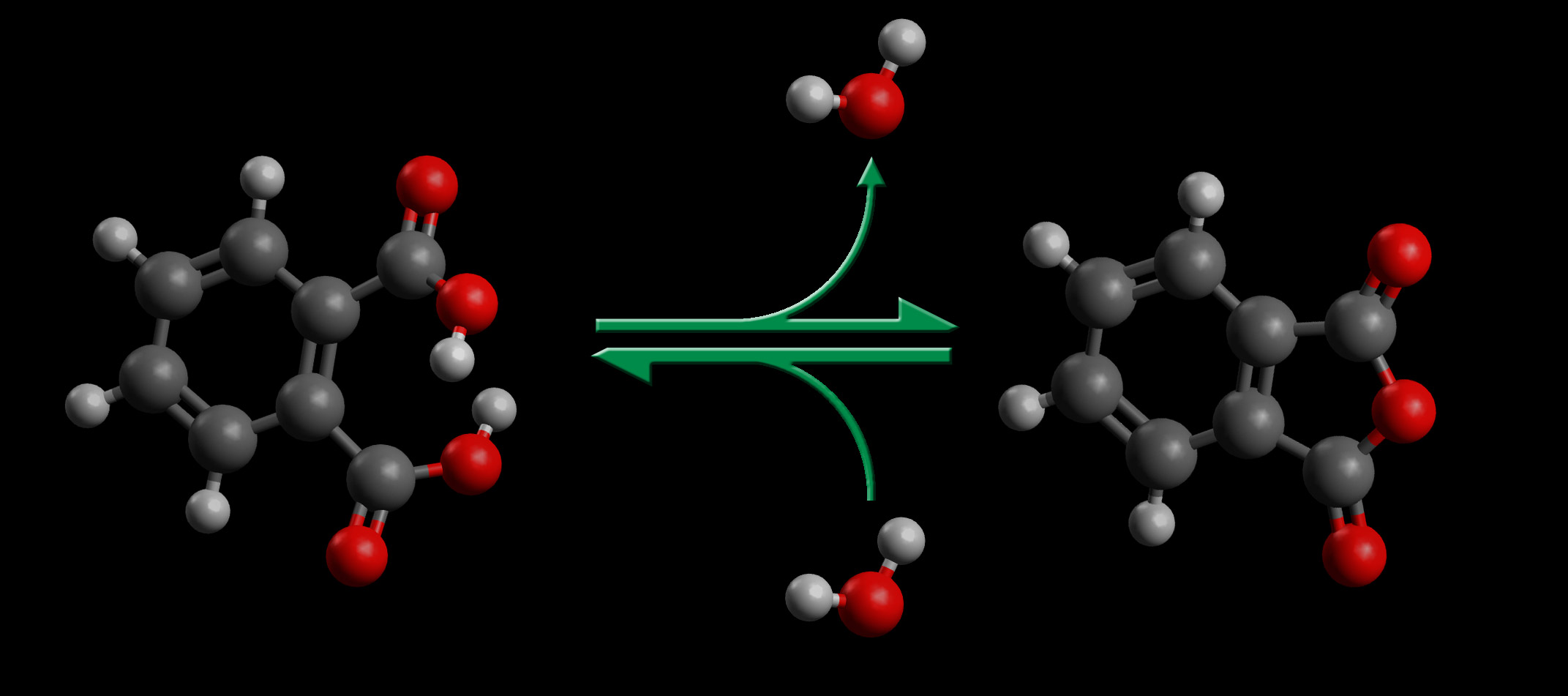
Reaktionsgeschwindigkeit und Entropie, Reaktion 3
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sind die beiden COOH-Gruppen an einen Benzolring gebunden. Die freie Drehbarkeit ist jetzt stärker eingeschränkt. Die Entropie ist noch geringer geworden. Auf die Reaktionsgeschwindigkeit der Anhydrid-Bildung wirkt sich diese Entropie-Reduktion stark aus, die relative Reaktionsgeschwindigkeit ist jetzt 108 mal (100 Millionen mal) größer als bei der ersten Reaktion mit den beiden unabhängigen Essigsäure-Molekülen.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.