Viele wichtige Fakten zum Thema Reaktionsgeschwindigkeit haben wir bereits auf den vorhergehenden Seiten gelernt: Was versteht man unter der Reaktionsgeschwindigkeit, wie kann man sie messen, wie hängt die Reaktionsgeschwindigkeit von der Konzentration der Edukte ab und so weiter.
Auf dieser Seite wollen wir uns mit ein paar Begriffen beschäftigen, die im Zusammenhang mit der Reaktionskinetik (so nennt man das Teilgebiet der Chemie, das sich mit Reaktionsgeschwindigkeiten beschäftigt) immer wieder auftauchen.
Durchschnittsgeschwindigkeit
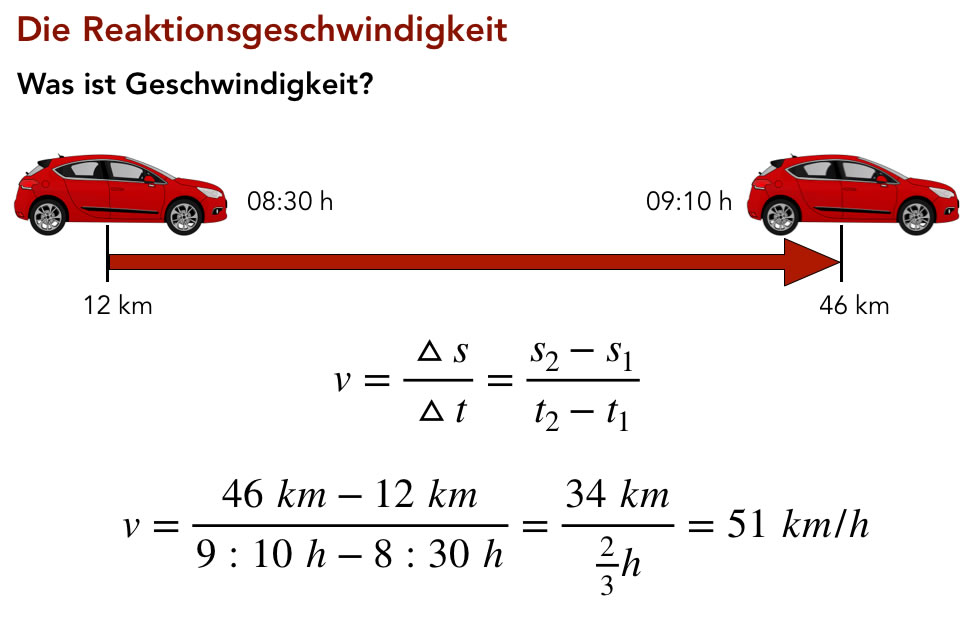
Geschwindigkeit eines Autos
Autor: Ulrich Helmich 2021, Bild des Autos: PixaBay, Lizenz: Public domain
Bereits auf der Einführungsseite in das Thema "Reaktionsgeschwindigkeit" haben wir das Auto-Beispiel kennengelernt. Die dort errechnete Geschwindigkeit von 51 km/h ist nichts anderes als eine Durchschnittsgeschwindigkeit. Wenn man dagegen während der Fahrt auf den Tacho schaut, sieht man dort die Momentangeschwindigkeit. Wie kann man diese beiden Begriffe nun auf chemische Reaktionen übertragen?
Die Durchschnittsgeschwindigkeit einer chemischen Reaktion haben wir ebenfalls schon auf der Einführungsseite kennengelernt.
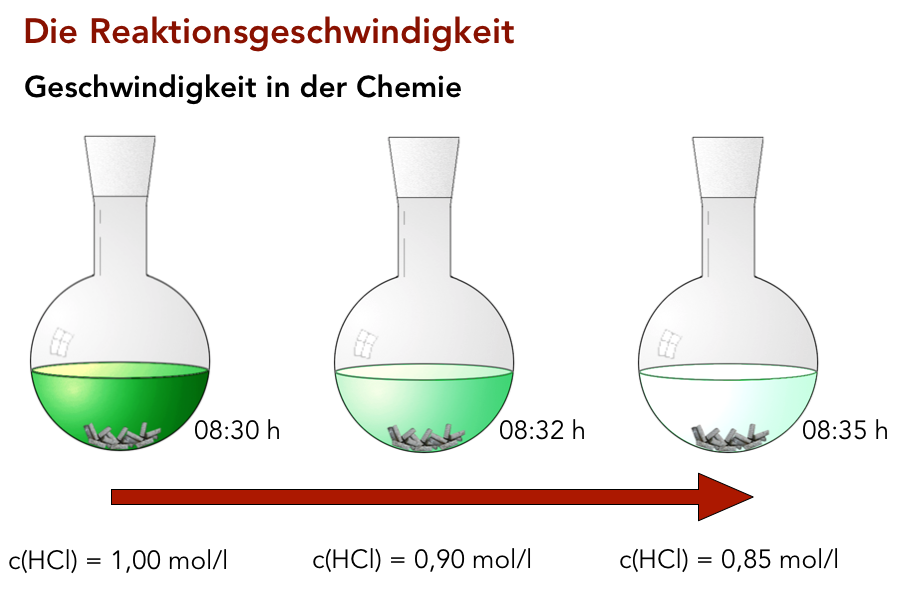
Abnahme der Edukt-Konzentration während einer chemischen Reaktion
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Wir hatten dort ausgerechnet, dass die durchschnittliche Reaktionsgeschwindigkeit für die erste Zeitspanne von 8:30 bis 8:32 genau 0,83 mmol l-1 s-1 beträgt. Um diese Erkenntnis noch einmal zu vertiefen, wollen wir jetzt die Reaktionsgeschwindigkeit für die zweite Zeitspanne berechnen.
Die Konzentrationsdifferenz Δc beträgt für die zweite Zeitspanne 0,05 mol l-1, und die Zeitdifferenz Δt 3 Minuten bzw. 180 Sekunden. Damit erhalten wir eine Durchschnittsgeschwindigkeit von Δc/Δt = 0,00028 mol l-1 s-1 bzw. 0,28 mmol mol l-1 s-1.
Unter dem Begriff Durchschnittsgeschwindigkeit versteht man also das, was man im Schülerexperiment leicht messen kann.
Bei der Reaktion von Salzsäure mit Zink oder Magnesium gibt es zwei Verfahren, um die Reaktionsgeschwindigkeit zu messen:
- könnte man in Minutenabständen eine sehr kleine Probe der Säure entnehmen, mit dest. Wasser verdünnen und dann die in der Probe enthaltende Stoffmenge n(HCl) durch Titration mit NaOH bestimmen und so die Konzentration c(HCl) im Rundkolben berechnen.
- könnte man den Wasserstoff, der bei der Reaktion produziert wird, auffangen und in bestimmten Zeitabständen das aufgefangene Volumen V(H2) notieren.
Schauen wir uns zum Verfahren 2 noch einmal das Rechenbeispiel von der letzten Seite an:
Rechenbeispiel
Es wurden 50 ml HCl der Konzentration 1 mol/l verwendet. In den ersten 10 Sekunden wurden im Kolbenprober 26 ml Wasserstoff-Gas aufgefangen. Wie groß ist die durchschnittliche Reaktionsgeschwindigkeit während der ersten 10 Sekunden?
Oft rechnet man bei Wasserstoff-Gas unter Normalbedingungen mit einem Molvolumen von 24 Litern. Wenn wir also 26 ml aufgefangen haben, so entspricht das etwas mehr als 1 mmol H2; nämlich 26/24 = 1,083 mmol. Dieses Volumen hat sich während der ersten 10 Sekunden gebildet, also ist die durchschnittliche Reaktionsgeschwindigkeit während der ersten 10 Sekunden 0,1083 mmol * s-1 für V(HCl) = 0,05 Liter. Auf einen Liter bezogen, hätten wir dann vR = 21,67 mmol * l-1 * s-1.
Mit der Tabellenkalkulation (ebenfalls letzte Seite) haben wir sogar die Durchschnittsgeschwindigkeiten für alle Zeitintervalle ausgerechnet.
Anfangsgeschwindigkeit
Als Anfangsgeschwindigkeit bezeichnet man die Durchschnittsgeschwindigkeit der Reaktion während der ersten gemessenen Zeitspanne. Die Anfangsgeschwindigkeit aus dem obigen Rechenbeispiel beträgt also:
$0,02167\frac{mol/l}{s}$.
Natürlich könnte man die Anfangsgeschwindigkeit viel genauer feststellen, wenn man schon nach der ersten Sekunde das produzierte Wasserstoff-Volumen ablesen könnte. Mit Hilfe eines Smartphones sollte das heute kein Problem mehr sein, man befestigt das Gerät einfach an einem Stativ und filmt dann die Bewegung des Kolbenprobers. Dann kann man später in Ruhe nachsehen, wie viel Gas in der ersten Sekunde produziert wurde oder sogar in der ersten Zehntelsekunde.
Praktisch gibt es da natürlich ein paar Probleme. In dem Reaktionskolben befindet sich ja zunächst nur eines der beiden Edukte, entweder die Salzsäure oder das Metall. Das zweite Edukt muss dann möglichst zügig zugegeben werden. Aber das Hineinschütten der Salzsäure oder des Metallpulvers dauert eine gewisse Zeitspanne - je nach Geschicklichkeit des Experimentators. In dieser Zeitspanne, die durchaus bis zu zwei Sekunden betragen kann, beginnt das Stoffgemisch ja bereits zu reagieren. Das entstehende Gas wird aber noch nicht aufgefangen, weil der Kolben ja noch geöffnet ist. Erst wenn der Stopfen mit dem Winkelrohr aufgesetzt ist, beginnt sich der Kolbenprober zu füllen. Daher ist es schon sinnvoll, als Zeitspanne für die Anfangsgeschwindigkeit die ersten 5 oder 10 Sekunden zu wählen.
Natürlich könnte man jetzt ein paar Tricks anwenden, um beide Edukte gleichzeitig zur Reaktion zu bringen. Man könnte zum Beispiel einen Erlenmeyerkolben mit flachem Boden nehmen, das Metallpulver in den Kolben geben und dann ein Röhrchen mit der Salzsäure vorsichtig auf den Boden stellen. Dann verschließt man den Kolben vorsichtig und schüttelt ihn, so dass das Röhrchen mit der Säure umkippt. Aber dann könnte es auch wieder sein, dass nicht die gesamte Salzsäure sofort zur Reaktion kommt, sondern nur ein Teil. Der andere Teil der Säure fließt dann erst in den nächsten zwei, drei Sekunden aus dem Röhrchen in das Metallpulver.
Momentangeschwindigkeit
Die Momentangeschwindigkeit ist ein eher abstrakter Wert, der im Schulunterricht nicht direkt gemessen werden kann.
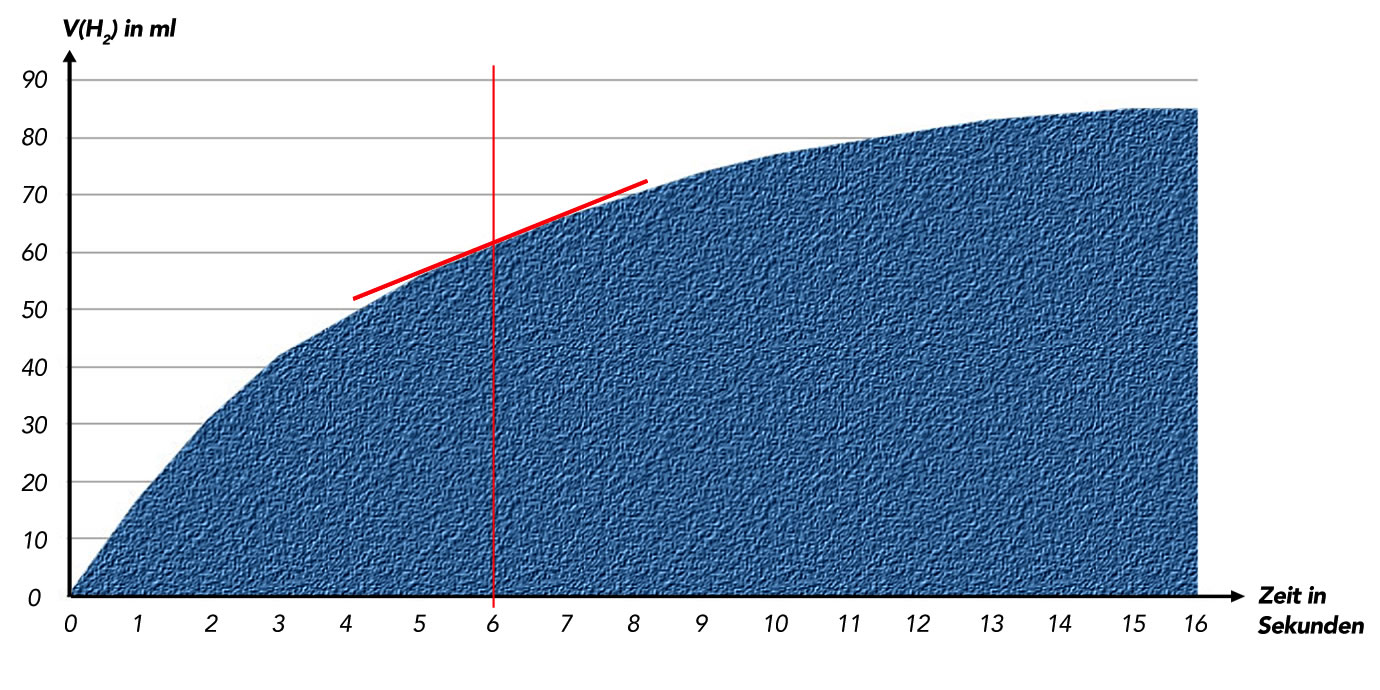
Visualisierung einer Momentangeschwindigkeit
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Formal ist die Momentangeschwindigkeit die Steigung der Tangente, die man an eine Kurve anlegt, die man aus den Messungen gewonnen hat. Die Steigung der obigen Tangente kann man leicht mit einem Steigungsdreieck ausrechnen. Das wollen wir jetzt einmal praktizieren.
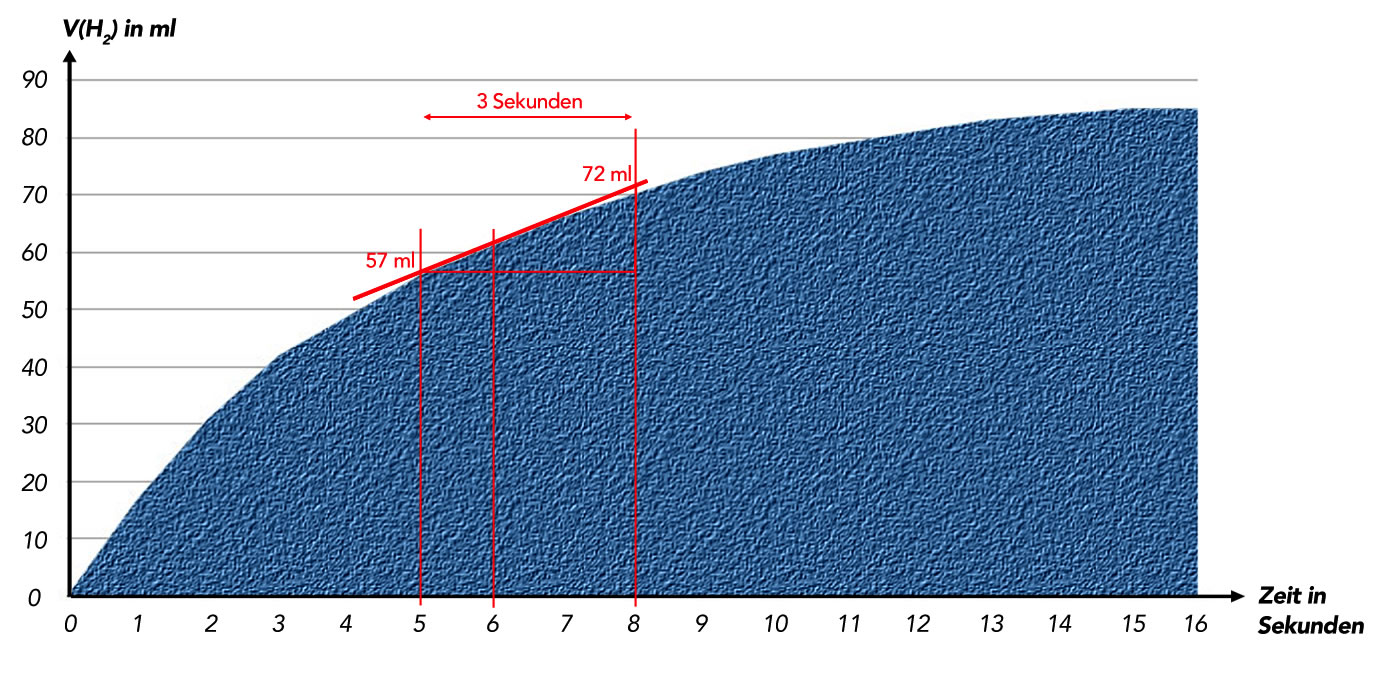
Ermittlung der Tangentensteigung mit einem Steigungsdreieck
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Innerhalb von 3 Sekunden werden 72 - 57 = 15 ml Wasserstoffgas produziert, also im Schnitt 5 ml pro Sekunde. Das entspricht 5/24 = 0,21 mmol H2/s oder 0,42 mmol HCl/s, die verbraucht werden. Wir gehen wieder von 50 ml HCl in dem Kolben aus, also müssen wir das Ganze mit dem Faktor 1/0,05 = 20 multiplizieren und erhalten dann 8,4 mmol/s bzw. 0,0084 mol/s HCl als momentane Reaktionsgeschwindigkeit für den Zeitpunkt t = 6s.
Mathematisch gesehen ist die Momentangeschwindigkeit zu einem Zeitpunkt t die 1. Ableitung der Konzentrations-Zeit-Kurve einer durchgeführten Messung. Oder, anders formuliert, die Momentangeschwindigkeit ist die Durchschnittsgeschwindigkeit in einem Zeitintervall, das gegen Null geht.
Seitenanfang -
Weiter mit dem Thiosulfat-Versuch ...