Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- was man allgemein unter der Reaktionsgeschwindigkeit versteht,
- dass die Geschwindigkeit einer chemischen Reaktion von der Aktivierungsenergie der Reaktion abhängt: Je kleiner die Aktivierungsenergie, desto schneller die Reaktion
- dass die Reaktionsenergie bzw. -enthalpie nur einen indirekten Einfluss auf die Reaktionsgeschwindigkeit hat.
Was versteht man unter der Reaktionsgeschwindigkeit?
Sieben chemische Reaktionen im Vergleich
- Explosion von Dynamit (YouTube-Video)
- Aufblasen eines Airbags (YouTube-Video)
- Neutralisation von Salzsäure (YouTube-Video)
- Backen eines Kuchens
- Rosten von Eisen
- Umsetzung von Essigsäure oder Salzsäure mit Magnesium (YouTube-Video)
- Umsetzung von Eisen mit Schwefel (YouTube-Video)
Wenn Leute den Begriff "chemische Reaktion" hören, denken die meisten zunächst an eine Explosion (Reaktion 1 und 2), weil hier sehr viel Energie in sehr kurzer Zeit freigesetzt wird. In Wirklichkeit verlaufen die meisten chemischen Reaktionen langsamer (Reaktion 3, 6 und 7) oder sogar unmerklich langsam (Reaktion 5).
Was versteht man überhaupt unter den Begriff Reaktionsgeschwindigkeit?
Beispiel Autofahren
Bei einem Auto oder Fahrrad ist klar, was man unter Geschwindigkeit versteht, nämlich die pro Zeiteinheit zurückgelegte Strecke. Daher ist die Einheit dieser Geschwindigkeit immer Längeneinheit / Zeiteinheit, also beispielsweise m/s oder km/h.
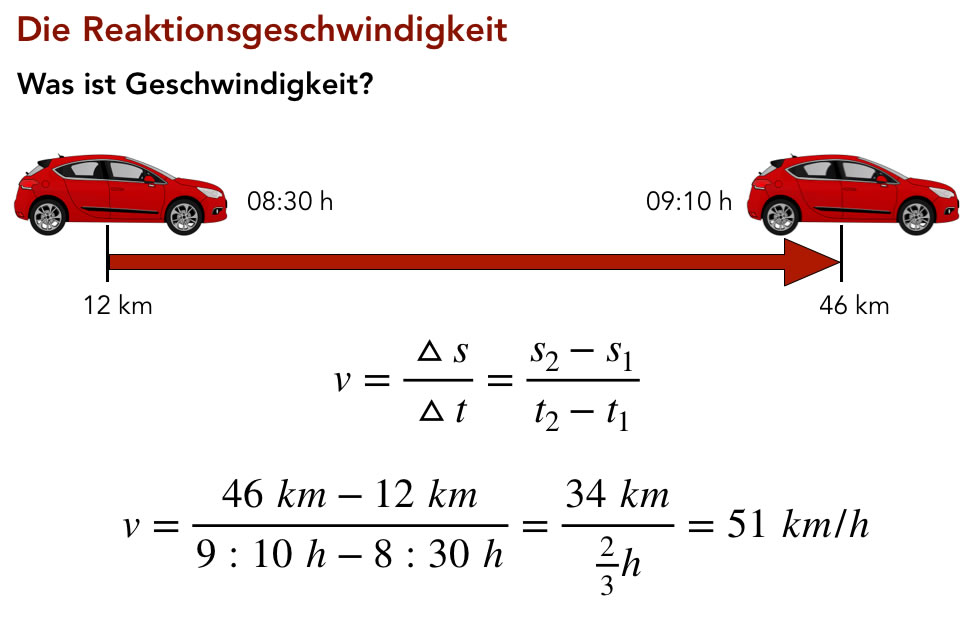
Geschwindigkeit eines Autos
Autor: Ulrich Helmich 2021, Bild des Autos: PixaBay, Lizenz: Public domain
Die obige Graphik - übrigens eine Seite aus meiner Präsentation "Reaktionskinetik 1" - zeigt, wie man die Geschwindigkeit eines Autos berechnet.
Um 8:30 Uhr startet das Auto bei einem Kilometerstand von 12 km (also handelt es sich wohl um ein fabrikneues Exemplar), dann fährt es 40 Minuten und hat dann 46 km auf dem Tacho. Innerhalb von 40 Minuten hat es also eine Strecke von 34 km zurückgelegt.
Die Geschwindigkeit errechnet sich dann nach der oben abgebildeten Formel, und man erhält 51 km/h.
Allerdings ist das nur die mittlere Geschwindigkeit oder Durchschnittsgeschwindigkeit. Schaut der Fahrer dagegen während der Fahrt auf den Tacho und stellt fest: "Meine Güte, ich fahre gerade 71 km/h, und es sind nur 50 km/h erlaubt!", dann sieht er die aktuelle Geschwindigkeit oder die Momentangeschwindigkeit.
Auf diese beiden Begriffe, Durchschnittsgeschwindigkeit und Momentangeschwindigkeit, werden wir im Laufe dieser Seiten noch zu sprechen kommen.
Beispiel Reaktion von HCl mit Zn oder Mg
Bei einer chemischen Reaktion wird keine Strecke zurückgelegt, aber die Konzentration der Ausgangsstoffe nimmt ab, während die Konzentration der Endprodukte zunimmt.
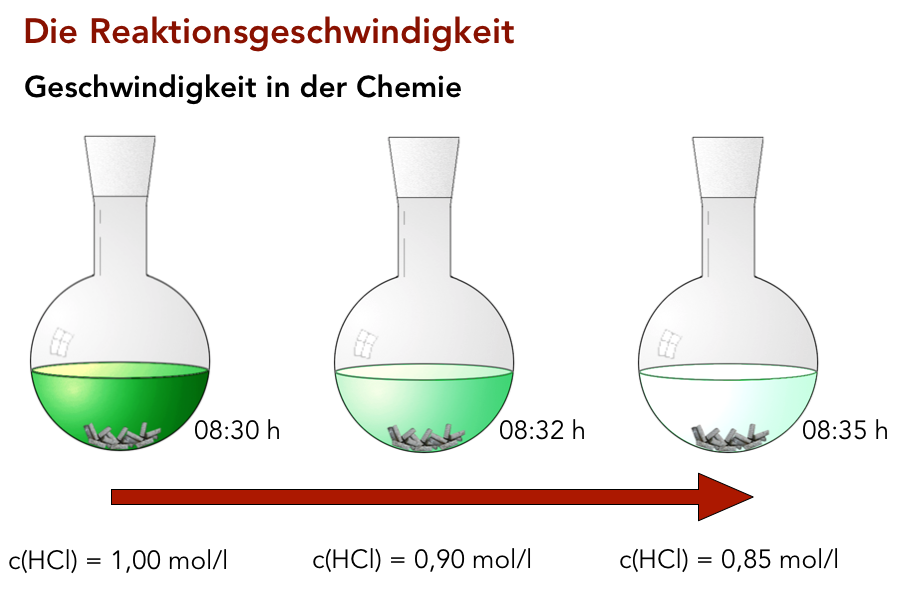
Abnahme der Edukt-Konzentration während einer chemischen Reaktion
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier (Bild 7 der Präsentation "Reaktionskinetik 1") sehen wir die Reaktion von Salzsäure mit Zink- oder Magnesiumspänen in einem Rundkolben. Die Konzentration der Salzsäure ist durch die Intensität der Grünfärbung dargestellt.
Um 8:30 Uhr beginnt der Versuch, die Konzentration der Salzsäure c(HCl) hat noch den Anfangswert 1 mol/l. Nach 2 Minuten, also um 8:32 Uhr, hat ein Teil der Salzsäure schon mit dem Zink oder Magnesium reagiert, daher ist die Konzentration auf 0,9 mol/l gesunken. Nach weiteren 3 Minuten ist c(HCl) sogar schon auf 0,85 mol/l gesunken.
Bei den Produkten kann man das genaue Gegenteil erwarten: Am Anfang ist die Konzentration des Reaktionsprodukts MgCl2 oder ZnCl2 noch Null. Im Laufe der Zeit steigt diese Konzentration aber an, bis die Reaktion vollständig abgeschlossen ist oder einen Gleichgewichtszustand erreicht hat.
Die Reaktionsgeschwindigkeit ist nun ein Maß für die zeitliche Zunahme der Produktkonzentration bzw. für die zeitliche Abnahme der Eduktkonzentration. Ein exakter Ausdruck dafür wäre
$v_{R} = \frac{\vartriangle c}{\vartriangle t}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Dabei steht Δc für den Konzentrationsunterschied in der gemessenen Zeitspanne Δt.
Rechenbeispiel zur Verdeutlichung:
Zu Beginn der Reaktion um 08:30 Uhr hat die Salzsäure HCl eine Konzentration von c(HCl) = 1,00 mol/l. Nun gibt man Magnesiumband in den Erlenmeyerkolben mit der Salzsäure und startet die Reaktion. Nach genau 2 Minuten entnimmt man eine kleine Probe der Säure und titriert sie mit Natronlauge, um die aktuelle Säurekonzentration zu bestimmen. Jetzt stellt man fest, dass die Konzentration c(HCl) nur noch 0,90 mol/l ist.
Welchen Wert hat nun die Reaktionsgeschwindigkeit in dieser Zeitspanne?
Der Konzentrationsunterschied ist Δc = c2 - c1 = 0,90 mol/l - 1,00 mol/l = -0,10 mol/l. Der Zeitunterschied ist Δt = t2 - t1 = 120 s.
Der Quotient Δc / Δt ist dann
$v_{R} = \frac{\vartriangle c}{\vartriangle t} = \frac{-0,10 mol/l}{120s} = -0,00083 \frac{mol}{l \cdot s} $
Eine Reaktionsgeschwindigkeit hat aber immer einen positiven Wert. Wenn man die Abnahme der Edukt-Konzentration misst, erhält man aber stets einen negativen Wert für die Reaktionsgeschwindigkeit. Daher multipliziert man in diesem Fall den Wert mit -1 und erhält vR = 0,00083 mol l-1 s-1 oder 0,83 mmol l-1 s-1.
Reaktionskinetische Überlegungen können Geld sparen und die Umwelt schonen
Gerade für die chemische Industrie ist die Abschätzung von Reaktionsgeschwindigkeiten sehr wichtig. Ein Produktionsprozess ist nur dann ökonomisch (wirtschaftlich), wenn die gewünschten Produkte in möglichst kurzer Zeit hergestellt werden können. Da auf diese Weise vielleicht auch Strom, Wärme, Gas, Rohstoffe etc. eingespart werden können, ist die Produktion dann auch ökologischer, schont also die Umwelt stärker.
Daher ist es wichtig zu wissen, von welchen Faktoren die Reaktionsgeschwindigkeit abhängt und wie man durch Veränderung dieser Faktoren Produktionsprozesse beschleunigen und gleichzeitig auch die Ausbeute erhöhen kann. Mit der Beschleunigung von Produktionsprozessen beschäftigt sich das Teilgebiet der Reaktionskinetik, mit der Erhöhung der Ausbeute das Teilgebiet der Thermodynamik. Die Reaktionskinetik behandelt Themen wie Reaktionsgeschwindigkeit und ihre Einflussfaktoren, die Thermodynamik behandelt Themen wie Energieumsätze bei Reaktionen und Beeinflussung der Lage des chemischen Gleichgewichts.
Thermodynamische Überlegungen
Machen wir zunächst einen kurzen Ausflug in das Gebiet der Thermodynamik. Welchen Einfluss hat die bei einer Reaktion freigesetzte Energie ΔH (Reaktionsenthalpie) auf die Reaktionsgeschwindigkeit? Ein erster, naheliegender Gedanke ist der: Je mehr Energie bei der Reaktion freigesetzt wird, desto schneller läuft die Reaktion ab. Ob das tatsächlich so ist, werden wir jetzt mal kritisch überprüfen. Dazu schauen wir uns mal das folgende Bild an:

Zwei exotherme Reaktionen im Vergleich
Autor: Ulrich Helmich, Lizenz: Public domain.
Welche der beiden abgebildeten Reaktionen läuft schneller ab, die linke oder die rechte?
Die Antwort auf diese Frage ist immer wieder überraschend! Beide Reaktionen laufen exakt gleich schnell ab. Zwar ist die rechte Reaktion heftiger als die linke, denn die Reaktionsenthalpie ΔH ist deutlich negativer als bei der rechten Reaktion. Die Reaktionsgeschwindigkeit ist aber gleich. Denn die Reaktionsgeschwindigkeit hängt nicht von der Reaktionsenthalpie ΔH ab, sondern von der Aktivierungsenergie EA.
Reaktionsenthalpie ΔH:
Die Reaktionsenthalpie ΔH ist die Energie, die bei der chemischen Reaktion im Endeffekt freigesetzt wird. Definiert ist ΔH als Enthalpie der Reaktionsprodukte minus Enthalpie der Ausgangsstoffe. Da bei exothermen Reaktionen ein energieärmerer Zustand angestrebt wird, ist die Energie der Reaktionsprodukte kleiner aus die Energie der Ausgangsstoffe. Zieht man nun die hohe Energie der Ausgangsstoffe (zum Beispiel 140 Einheiten) von der geringeren Energie der Endprodukte ab (zum Beispiel 50 Einheiten), dann erhält man einen negativen Wert für ΔH, in unserem Beispiel 50 - 140 = -90. Je negativer ΔH, desto mehr Energie wird bei der Reaktion freigesetzt und desto heftiger verläuft sie. Bei endothermen Reaktionen ist ΔH immer größer als Null.
Und was ist nun der Unterschied zwischen Reaktionsenergie und -enthalpie?
Für den praktischen Chemieunterricht in der Schule ist dieser Unterschied eher unwichtig, aber man sollte sich rechtzeitig an den Begriff "Enthalpie" gewöhnen, weil man den immer in der Fachliteratur findet.
Unter der Reaktionsenthalpie versteht man die Summe aus der Reaktionsenergie und dem Produkt aus Druck und Volumen des Systems, in dem die Reaktion stattfindet. Einfacher ausgedrückt: Bei der Reaktionsenthalpie berücksichtigt man auch den Druck, der in dem Kolben oder dem Reagenzglas herrscht. Bei der Reaktionsenergie spielt dieser Druck dagegen keine Rolle. Im Schulalltag ist dieser Unterschied belanglos, man könnte also genau so gut stets von der Reaktionsenergie sprechen.
Kinetische Überlegungen
Nachdem die Thermodynamik sich als wenig brauchbar erwiesen hat, wenn es um die Beschleunigung von Reaktionen geht, wenden wir uns nun der Reaktionskinetik bzw. kinetischen Einflussfaktoren zu. Betrachten Sie dazu die folgende Abbildung:

Zwei andere exotherme Reaktionen im Vergleich
Autor: Ulrich Helmich, Lizenz: Public domain.
Die linke Reaktion verläuft schneller. Die Reaktionsgeschwindigkeit hängt nur von der Aktivierungsenergie ab. Je größer die Aktivierungsenergie, desto langsamer verläuft eine Reaktion. Je höher der "Aktivierungsberg", desto mehr Widerstand muss die Reaktion überwinden und desto langsamer läuft sie ab.
Das linke Energiediagramm könnte beispielsweise für die Neutralisation von Salzsäure HCl mit Natronlauge NaOH stehen. Wenn man 1-molare HCl in ein Becherglas mit 1-molarer NaOH gießt, muss man keine Wärme zuführen, der Bunsenbrenner kann im Schrank bleiben. Die Aktivierungsenergie für diese Reaktion ist minimal. Aber mit einem Thermometer kann man feststellen, dass sich die Flüssigkeit erwärmt. Die Neutralisation von HCl mit NaOH läuft so schnell ab, dass man die Reaktionsgeschwindigkeit mit Schulmitteln nicht messen kann.
Das rechte Energiediagramm könnte zum Beispiel für die Reaktion von Schwarzpulver stehen. Wenn man etwas Schwarzpulver hergestellt hat (Mischung aus Schwefel, Kohle und Salpeter, wird zum Beispiel in Feuerwerksraketen eingesetzt), dann benötigt man die Flamme eines Bunsenbrenners oder eine glühende Eisennadel, um die Mischung zu entzünden. Die Aktivierungsenergie ist hier also sehr hoch. Wenn die Reaktion dann einmal in Gang gekommen ist, wird aber auch sehr viel Energie freigesetzt. Die Reaktion verläuft stark exotherm. Hier muss man wirklich aufpassen, dass man sich nicht verbrennt.
Die Geschwindigkeit einer chemischen Reaktion hängt von ihrer Aktivierungsenergie ab. Je geringer die Aktivierungsenergie EA, desto schneller verläuft die Reaktion.
Hat die Reaktionsenergie bzw. -enthalpie nicht doch einen Einfluss auf die Geschwindigkeit der Reaktion?
Eigentlich müsste man diese Frage mit einem deutlichen "Ja, unter Umständen" beantworten. Wie wir auf der nächsten Seite noch sehen werden, hängt die Geschwindigkeit einer Reaktion unter anderem von der Umgebungstemperatur ab: Je höher die Temperatur, desto schneller die Reaktion. Wird nun bei einer exothermen Reaktion viel Energie in Form von Wärme abgegeben, so steigt natürlich die Temperatur, und das beschleunigt die Reaktion. Anfangs läuft die Reaktion vielleicht noch sehr langsam ab, weil die Aktivierungsenergie recht hoch ist. Aber je länger die Reaktion läuft, desto wärmer wird es, und das beschleunigt natürlich die Reaktion.
Man könnte nun denken, die Fragestellung, inwieweit die Temperatur einen Einfluss auf die Reaktionsgeschwindigkeit hat, gehört in das Gebiet der Thermodynamik. Das ist aber nicht so. Eine Temperaturerhöhung beschleunigt die Reaktionsgeschwindigkeit und ist daher ein Gegenstand der Reaktionskinetik.
Nachdem wir diesen wichtigen Zusammenhang hergestellt haben, stellen sich mehrere wichtige Fragen:
- Von welchen Faktoren (außer der Temperatur) hängt die Reaktionsgeschwindigkeit nun noch ab?
- Wie kann man die Geschwindigkeit einer chemischen Reaktion möglichst genau messen?
- Lassen sich Reaktionsmechanismen nach kinetischen Kriterien unterteilen? Gibt es hinsichtlich der Kinetik unterschiedliche Typen von Reaktionen?
Die Frage 3 ist vielleicht nicht sofort verständlich, daher noch eine kurze Erklärung: Unter thermodynamischen Aspekten unterteilt man chemische Reaktionen bekanntlich in exotherme und endotherme, je nachdem, ob insgesamt Energie an die Umwelt abgegeben oder aus der Umwelt zugeführt wird. Die Frage ist nun, ob man auch unter kinetischen Aspekten chemische Reaktionen in verschiedene Typen einteilen kann. Vorab-Antwort: Man kann, sonst würde ich diese Seiten hier nicht schreiben...
Diese Fragen werden auf den nächsten Seiten beantwortet.
Seitenanfang -
Weiter mit Einflussfaktoren ...