Aufgabe 4
Gesättigte Fettsäuren haben deutlich höhere Schmelztemperaturen als ungesättigte Fettsäure mit der gleichen Zahl von C-Atomen.
- Recherchieren Sie die Schmelzpunkte der gesättigten und ungesättigten Fettsäuren mit 18 C-Atomen.
- Finden Sie eine Begründung für die Abhängigkeit des Schmelzpunktes von der Zahl der C=C-Doppelbindungen.
Teilaufgabe a)
- Stearinsäure (C18:0) 69 - 70 ºC
- Ölsäure (C18:1) 13 - 14 ºC
- Linolsäure (C18:2) -5 ºC
- Linolensäure (C18:3) -11 ºC
Teilaufgabe b)
Der Schmelzpunkt einer organischen Verbindung hängt stark von den intermolekularen Anziehungskräften zwischen den Molekülen des Feststoffes ab. Maßgeblich hierfür sind die verschiedenen van-der-Waals-Kräfte sowie die Bildung von H-Brücken-Bindungen.
Bei den langen Fettsäuren sind es vor allem die London-Kräfte (gehören zu den van-der-Waals-Kräften), die die Moleküle zusammenhalten. Die Stärke dieser London-Kräfte hängt von der Kontaktfläche der Moleküle ab. Daher haben Fettsäuren mit 18 C-Atomen grundsätzlich höhere Schmelzpunkte als beispielsweise Fettsäure mit 12 C-Atomen.
Die C=C-Doppelbindungen einer ungesättigten Fettsäuren führen wegen der cis-Konfiguration zu einem deutlichen Knick im Molekül, wie man in der Abbildung der Ölsäure gut sehen kann.
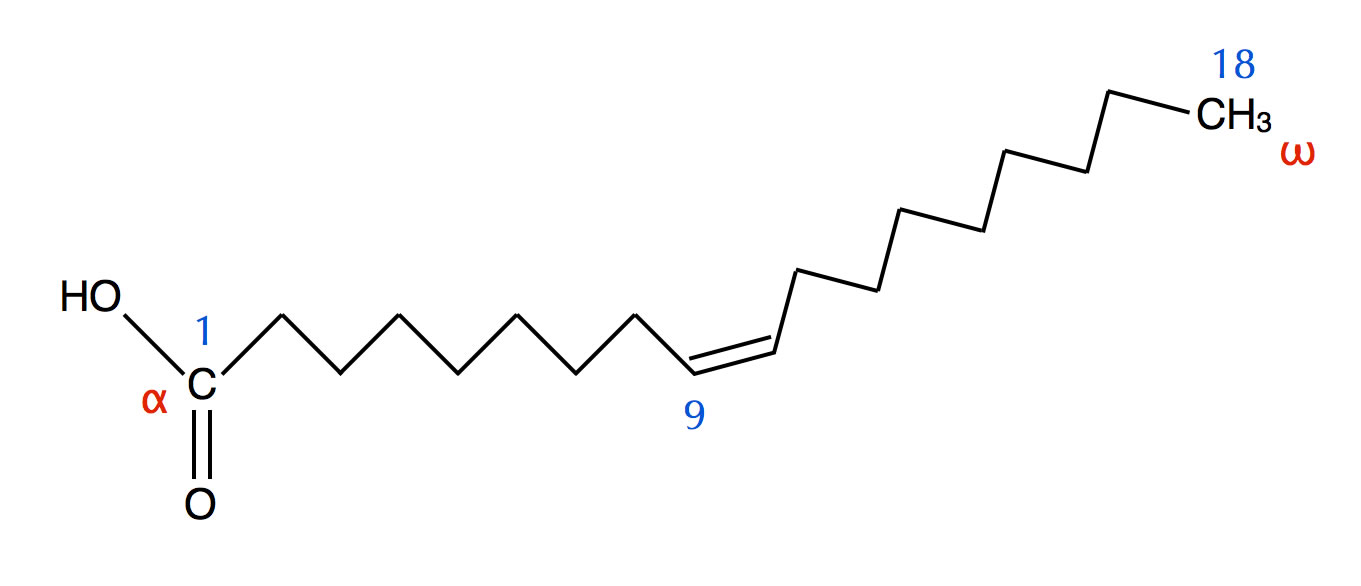
Strukturformel der Ölsäure
Autor: Ulrich Helmich, Lizenz: Public domain
Enthalten die Moleküle einer Fettsäure solche Knicke, dann können sich die Moleküle im Feststoff nicht mehr so gut zusammenlagern. Die London-Kräfte sind dann nicht mehr so stark, mit der Folge, dass der Schmelzpunkt sinkt. Je mehr C=C-Doppelbindungen im Molekül, desto mehr Knicke, und desto schlechter können die Moleküle einen regelmäßigen Kristall bilden. Daher sinkt der Schmelzpunkt mit jeder zusätzlichen Doppelbindung stark ab.