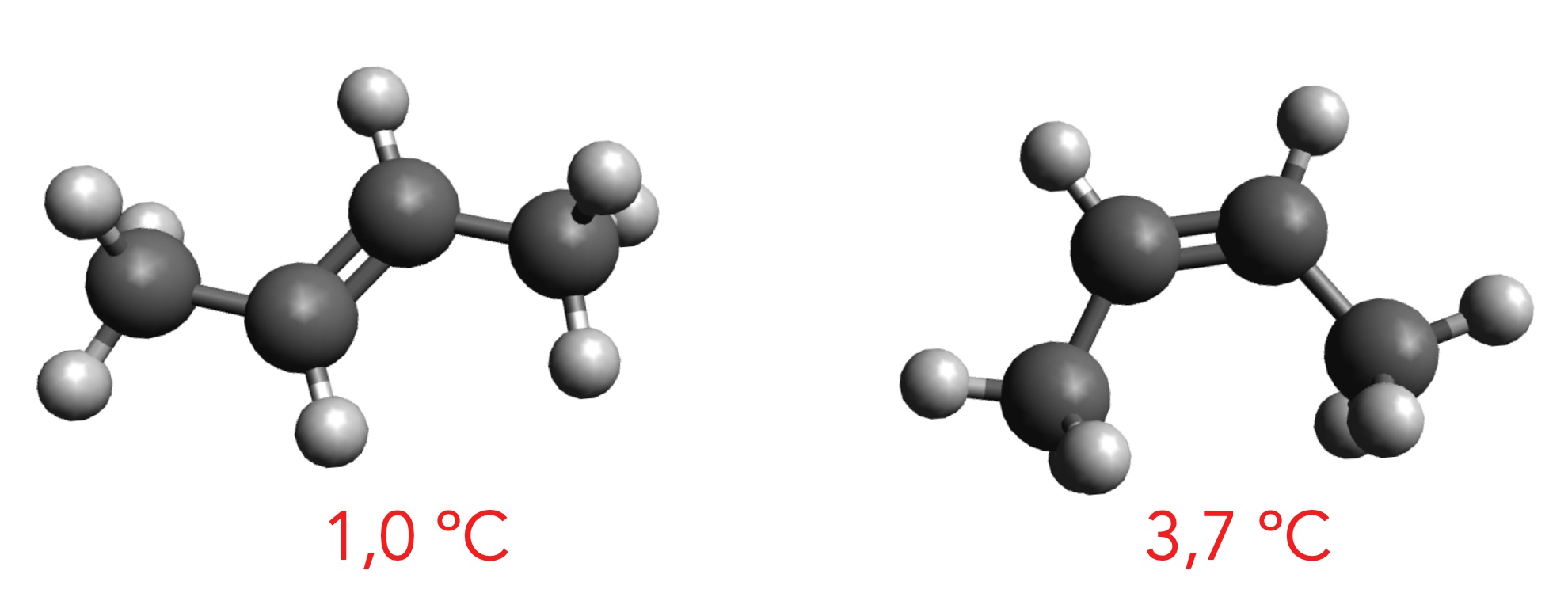
Die Siedetemperaturen von trans- und cis-But-2-en
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Aufgabe 3
Finden Sie einen Grund für die unterschiedlichen Siedepunkte der beiden Buten-Isomere.
Das trans-Isomer ist langgestreckter als das cis-Isomer, daher sollte man erwarten, dass das trans-Isomer wegen der größeren Kontaktfläche einen höheren Siedepunkt hat als das cis-Isomer. Nun ist aber genau das Gegenteil der Fall. Die Siedetemperatur des cis-Isomers ist etwas höher als die des trans-Isomers. Wie kann man das erklären?
Dazu müssen wir etwas ausholen. Neben den van-der-Waals-Kräften existieren weitere zwischenmolekulare Kräfte, vor allem die Dipol-Dipol-Kräfte sind hier zu nennen. H-Brücken spielen bei Alkanen und Alkenen keine Rolle, da keine O- oder N-Atome vorhanden sind. Aber wie sieht es mit den Dipol-Dipol-Kräften aus? Können die beiden Alkene überhaupt Dipole sein?
In der Tat, jedes der beiden Moleküle ist ein schwacher Dipol. Und das cis-Molekül scheint ein etwas stärkerer Dipol zu sein als das trans-Molekül.
Die beiden Methyl-Gruppen an den C=C-Doppelbindungen haben nämlich einen elektronenschiebenden Effekt, den man auch als +I-Effekt bezeichnet. Allerdings heben sich beim trans-Isomer die beiden +I-Effekt gegenseitig auf, während sie sich beim cis-Isomer verstärken. Das macht man sich am besten mit einer kleinen Zeichnung klar.

cis-2-Buten ist ein Dipol
Autor: Ulrich Helmich 02/2023, Lizenz: Public domain
In der Physik gibt es den Begriff des Kräfte-Parallelogramms. Zwei Kräfte, die in eine ähnliche Richtung weisen, verstärken sich gegenseitig. Weisen sie aber in entgegengesetzte Richtungen, schwächen sie sich ab oder heben sich sogar gegenseitig ganz auf. Und nichts anderes geschieht bei Dipol-Molekülen.