Adenosintriphosphat ist der universelle Energieträger der Zelle, oft wird er in Schulbüchern mit einem wiederaufladbaren Akku verglichen.
Auf dieser einführenden Lexikonseite erfahren Sie alles über ATP als Energieträger der Zelle.
Mechanismus der Hydrolyse
Auf dieser Seite für Fortgeschrittene wollen wir uns mit dem Mechanismus der ATP-Hydrolyse beschäftigen, also mit der enzymatischen Spaltung von ATP in ADP und anorganisches Phosphat. Die Hauptquelle für die Informationen auf dieser Seite ist das Lehrbuch "Biochemie" von Stryer, aber es wurden auch andere Quellen hinzugezogen.
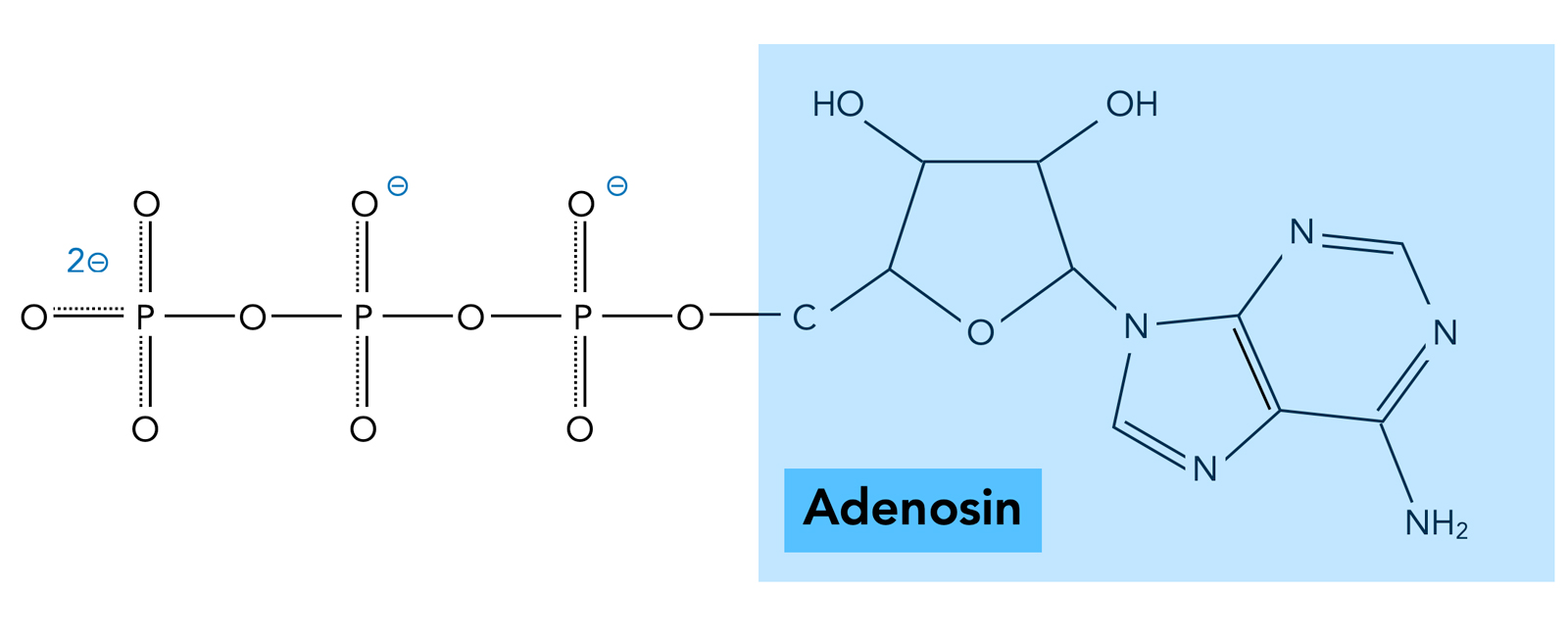
Das ATP-Molekül
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
Der Stryer stellt das ATP-Molekül grundsätzlich als vierfach negativ geladen dar. In der Wikipedia sind die O-Atome der drei Phosphatgruppen mit H-Atomen besetzt, hier ist das ATP-Molekül elektrisch neutral. Offensichtlich hängt die Ladung des ATP-Moleküls von dem pH-Wert des umgebenden Milieus ab; je mehr Protonen anwesend sind, desto weniger negative Ladungen sind am ATP zu finden.
Achten Sie auf die P-O-Bindungen im ATP. Die gestrichelten Linien deuten an, dass die Bindungselektronen teilweise delokalisiert sind, das heißt aber auch, dass die negativen Ladungen nicht an einem bestimmten O-Atom fixiert sind, sondern sich über die gesamte Phosphatgruppe verteilen.
Das folgende Bild zeigt nun, was passiert, wenn ein Wasser-Molekül das ATP-Molekül angreift. Allerdings ist diese Darstellung noch etwas vereinfacht, das nächste Bild zeigt dann den tatsächlichen Ablauf der ATP-Hydrolyse. Dennoch wollen wir uns zunächst die etwas einfachere Darstellung anschauen.
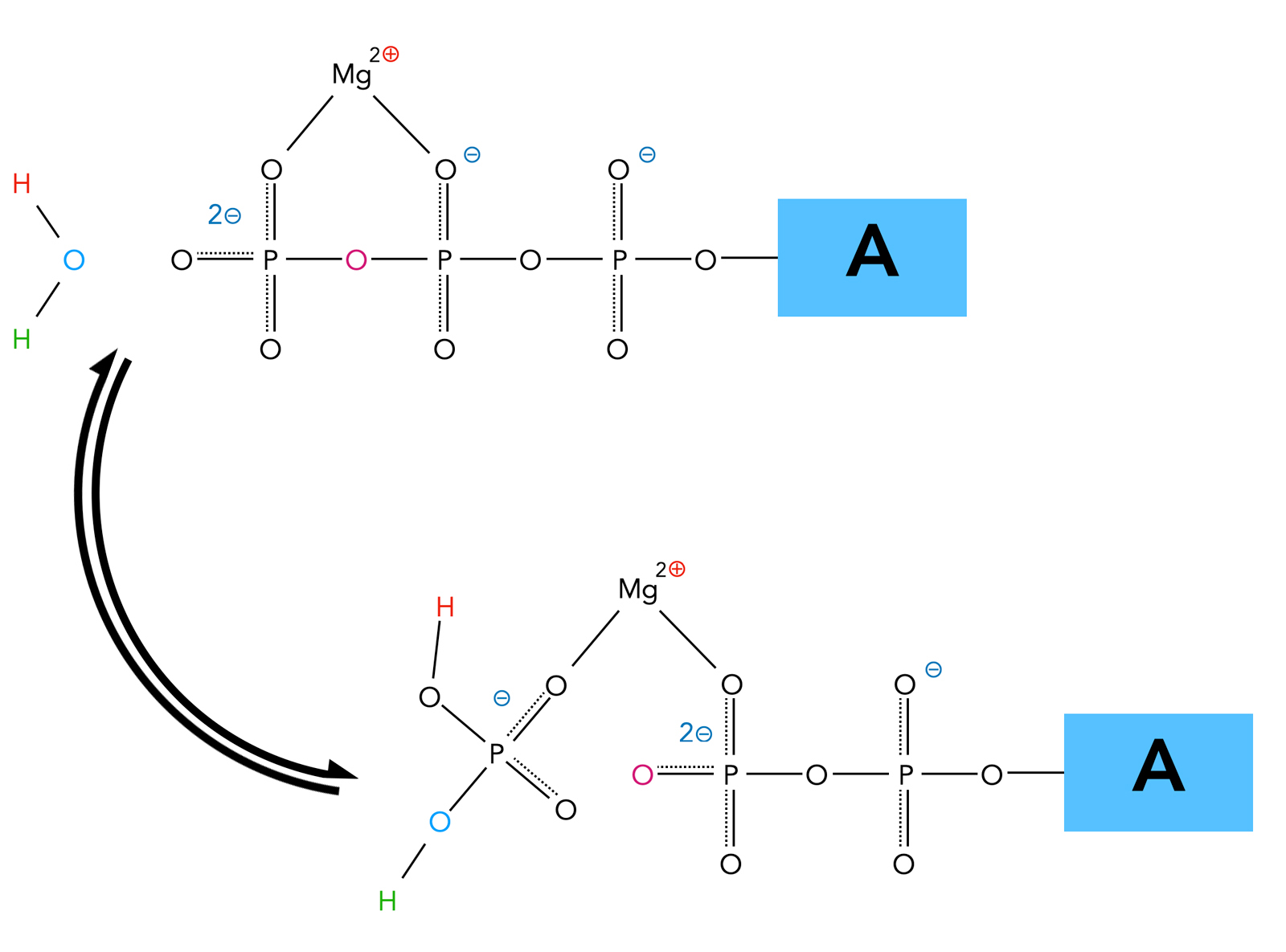
Hydrolyse des ATP-Moleküls, vereinfachte Darstellung
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
Der besseren Übersicht wegen wurden bestimmte Atome des Wassers und des ATP farbig gezeichnet.
ATP kann nur dann hydrolysiert werden, wenn es einen Komplex mit einem Mg2+-Ion gebildet hat. Das zweifach positiv geladene Ion verbindet sich mit den negativ geladenen Sauerstoff-Atomen der beiden "hinteren" Phosphatgruppen des ATP.
Das Wasser-Molekül greift das positiv polarisierte P-Atom des letzten Phosphatrestes nucleophil an (SN2-Reaktion), das rot gekennzeichnete O-Atom zwischen den beiden letzten Phosphatresten wird dabei als Nucleofug verdrängt und verbleibt dann bei dem vorletzten Phosphatrest. Die Trennung des letzten und des vorletzten Phosphatrestes ist damit also vollzogen, aber noch werden die beiden Phosphatreste durch das Magnesium-Ion zusammengehalten. Das rot gekennzeichnete H-Atom des Wasser-Moleküls setzt sich dann ein eines der O-Atome des abgespaltenen Phosphatrestes.
Ganz so "einfach" ist die Hydrolyse des ATP-Moleküls allerdings nicht, auf die Rolle des Enzyms sind wir noch gar nicht eingegangen. Dazu schauen wir uns das nächste Bild an, das ungefähr der Abbildung 9.45 aus dem Stryer entspricht, aber natürlich viel "schöner" aussieht.
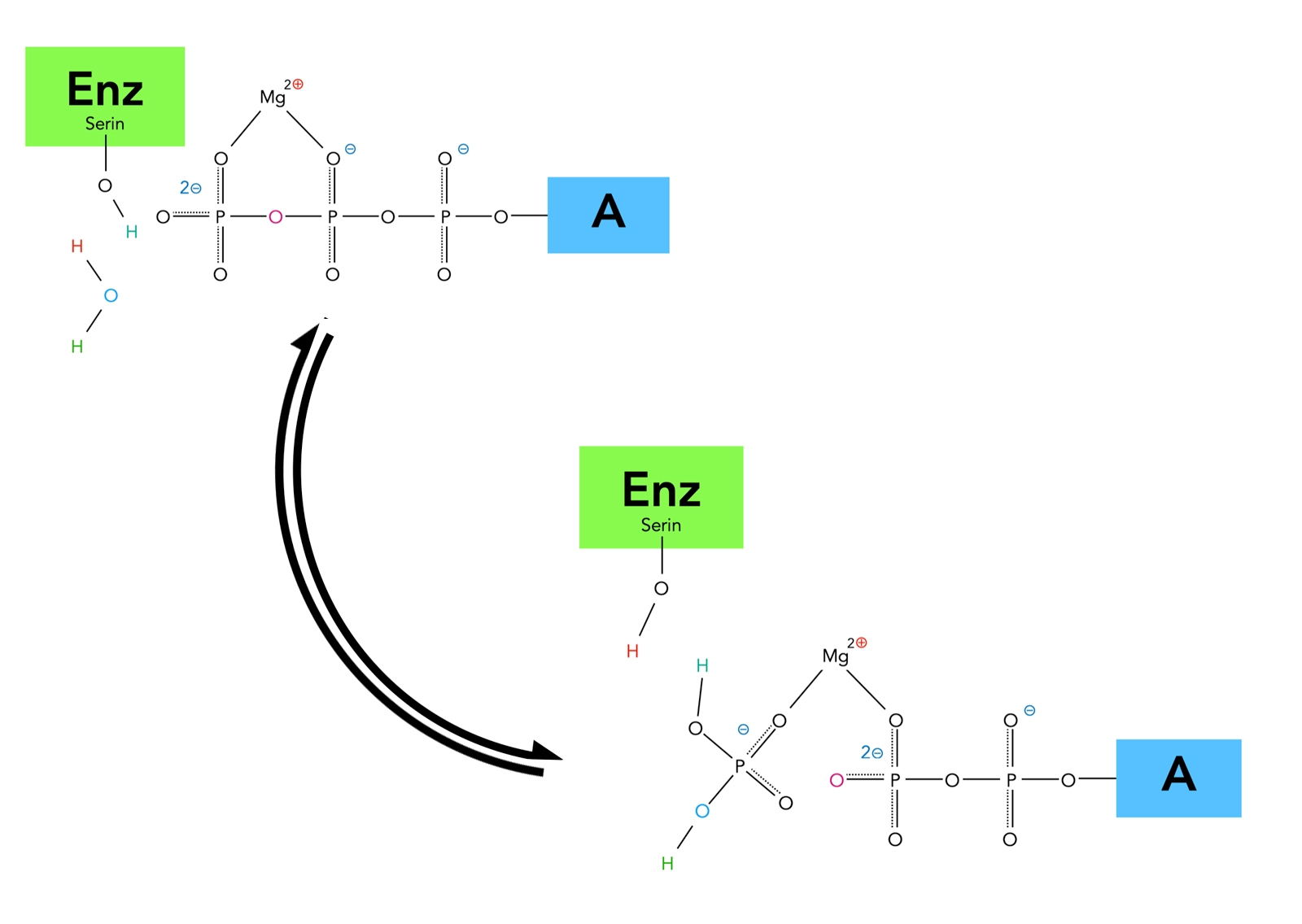
Hydrolyse des ATP-Moleküls, genauere Darstellung
Autor: Ulrich Helmich 03/2023, Lizenz: Public domain
Auf diesem Bild sieht man, dass die OH-Gruppe einer Serin-Seitenkette an der Reaktion beteiligt ist. Das Wasser-Molekül greift das P-Atom der letzten Phosphatgruppe in einer SN2-Reaktion nucleophil an, das rot gekennzeichnete O-Atom verlässt die letzte Phosphatgruppe als Nucleofug, und das H-Atom der Serin-OH-Gruppe setzt sich nun an eines der O-Atome der abgespaltenen Phosphatgruppe, wird dann aber durch das rot gekennzeichnete H-Atom des Wasser-Moleküls ersetzt.
Die Rolle des Magnesiums hat man durch Experimente herausgefunden, bei denen man ATPasen wie beispielsweise Myosin mit magnesiumfreier ATP-Lösung versetzt hat. Hier lief dann so gut wie keine Reaktion ab, erst nach Zugabe von Magensium-Ionen.
Dass es sich bei der Hydrolyse um eine SN2-Reaktion mit einem pentakoordinierten P-Atom handelt, hat man durch Experimente mit dem Vanadat-Ion VO43- herausgefunden. Dieses Ion ist ähnlich aufgebaut wie das Phosphat-Ion PO43-, kann also in einem ATP-Molekül eine Phosphatgruppe ersetzen. Während der Übergangszustand des H2O-ATP-Komplexes zu instabil ist, um untersucht zu werden, ist dies möglich, wenn man die endständige Phosphatgruppe des ATP durch eine Vanadat-Gruppe ersetzt. Solche Untersuchungen haben dann die Vermutung bestätigt, dass ein pentakoordiniertes P-Atom im Übergangszustand vorliegt, so wie man es von den SN2-Reaktionen kennt, die üblicherweise im Chemieunterricht der Oberstufe behandelt werden.
Laut Stryer ist die Hydrolyse noch etwas komplexer als hier abgebildet, aber wer noch weitere Einzelheiten wissen will, sollte sich tatsächlich die Original-Literatur, also den Stryer, ansehen.
Quellen:
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.