Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- wie die drei hypothetischen Replikationsmechanismen der DNA heißen und wie sie ablaufen,
- dass die DNA-Replikation nach dem semikonservativen Mechanismus abläuft.
- dass die Einwände von Max Delbrück gegen den semikonservativen Mechanismus durchaus ihre Berechtigung hatten,
- was man unter einer Dichtegradientenzentrifugation versteht,
- was man unter schwerer und leichter bzw. 14N- und 15N-DNA versteht,
- wie Meselson und Stahl mit Hilfe der 15N-Markierung und einer Dichtegradientenzentrifugation nachgewiesen haben, dass der Replikationsmechanismus semikonservativ ist.
- wie Taylor mit Hilfe der Autoradiographie den semikonservativen Mechanismus nachgewiesen hat.
Grundsätzliches
Wir wissen ja bereits, dass sich die DNA nach einem semikonservativen Mechanismus verdoppelt oder repliziert. Rein theoretisch könnte sich die DNA auch auf mehrere andere Weisen verdoppeln. So wurden in der Frühzeit der DNA-Forschung drei verschiedene Replikationsmechanismen diskutiert: der konservative, der semikonservative und der disperse Mechanismus. Diese drei möglichen Mechanismen werden durch das folgende Bild schematisch dargestellt.
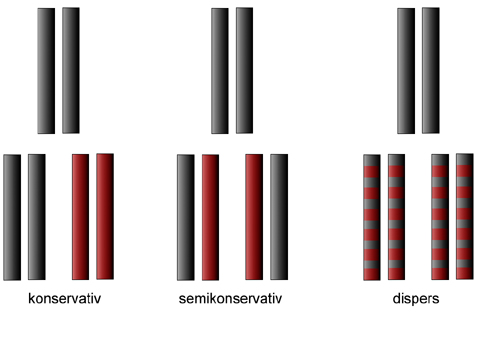
Drei theoretisch mögliche Replikationsmechanismen: konservativ, semikonservativ und dispers
Autor: Ulrich Helmich, Lizenz: Public domain.
In der oberen Reihe sehen wir jeweils die DNA, die verdoppelt werden soll. In der Reihe darunter kann man das Ergebnis der Replikation, die Tochter-DNA, erkennen.
- Bei der konservativen Replikation wird einfach eine vollständige Kopie der Mutter-DNA gemacht. Die ursprüngliche DNA bleibt vollständig erhalten, die neu synthetisierte DNA ist komplett aus neuen Nucleotiden zusammengesetzt.
- Bei der semikonservativen Replikation bleibt die ursprüngliche DNA in jedem Tochter-Molekül zur Hälfte erhalten. Die andere Hälfte wird neu ergänzt.
- Die disperse Replikation verläuft im Prinzip ähnlich, auch hier bleibt in jeder Tochter-DNA die Hälfte der Mutter-DNA erhalten, die andere Hälfte wird durch neue Nucleotide ersetzt. Allerdings läuft die Neusynthese der DNA völlig anders ab als bei der semikonservativen Replikation. Bei der dispersen Replikation sind alte und neue Nucleotide stark vermischt.

|
Der Mechanismus der dispersen Replikation wurde von Max Delbrück, einem berühmten Physiker vorgeschlagen. Watson und Crick hatten bereits in ihren ersten Artikeln einen semikonservativen Replikationsmechanismus vorgeschlagen, bei dem sich die DNA-Doppelhelix komplett entwinden und in zwei Einzelstränge zerlegen sollte, die dann durch die komplementären Basen zu neuen Doppelsträngen ergänzt werden. Delbrück sah aber das Problem der DNA-Entspiralisierung. Wie soll sich die komplette DNA eines Chromosoms überhaupt vollständig entwinden, ohne dass ein riesiges Knäuel entsteht? Er schlug daher vor, dass sich immer nur ein winziger Teil der DNA entwindet und aufspaltet und die beiden ca. 10 bis 20 Nucleotide langen Einzelstränge wieder vervollständigt werden. Damit wäre das Problem der DNA-Entwindung gelöst. Die Folge wäre allerdings ein Mosaik aus alter und neuer DNA, willkürlich über die DNA-Doppelhelix verteilt [4]. |
Die Frage, die wir uns auf dieser Seite stellen wollen, ist die: Wie fand man eigentlich heraus, dass die DNA tatsächlich semikonservativ und nicht auf andere Weise repliziert wird? Dazu betrachten wir zwei historisch wichtige Experimente, einmal die Untersuchungen von Meselson und Stahl, und dann die Experimente von Taylor.
Die Meselson-Stahl-Experimente
"Das schönste Experiment der Zellbiologie"
Bereits Watson und Crick hatten 1953 in ihrer ersten Veröffentlichung zur Struktur der DNA einen semikonservativen Replikationsmechanismus vorgeschlagen. Beweisen konnten sie diesen Mechanismus allerdings nicht, er war rein hypothetischer Natur, aber durchaus logisch.
Matthew Meselson und Frank Stahl, die am California Institute of Technology arbeiteten, wollten es 1958 genau wissen: läuft die Replikation tatsächlich nach dem semikonservativen Mechanismus ab? Um diese Versuche zu verstehen, müssen wir hier aber zunächst einmal etwas ausholen, um die Experimentiertechniken zu verstehen.
Betrachten wir dazu das folgende Bild:
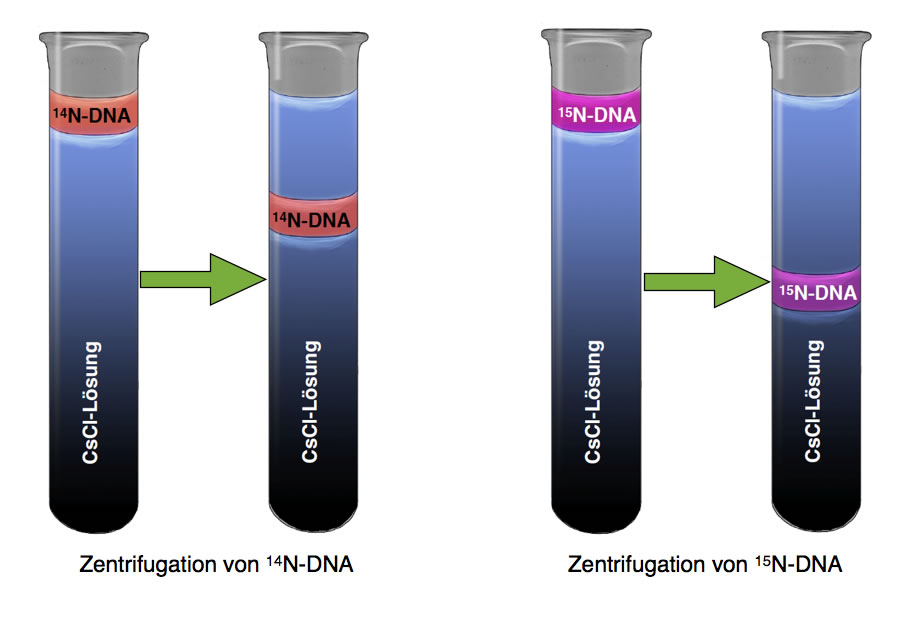
Dichtegradientenzentrifugation von normaler 14N- und schwerer 15N-DNA
Autor: Ulrich Helmich, Lizenz: Public domain.
Wir sehen hier zwei Versuche. In dem ersten Versuch (links) hat man eine Probe normaler DNA in ein Reagenzglas mit einer Cäsiumchlorid-Lösung gegeben. Der Farbverlauf in dem Reagenzglas deutet es schon an: Die Cäsiumchlorid-Lösung hat nicht überall die gleiche Konzentration und Dichte. Die Lösung ist oben im Reagenzglas noch recht stark verdünnt, während sie nach unten hin immer konzentrierter wird. Man spricht hier auch von einem Dichtegradienten, denn die Dichte der Lösung nimmt von oben nach unten hin kontinuierlich zu.
Einen solchen Dichtegradienten können Sie selbst übrigens ganz leicht zu Hause herstellen. Nehmen Sie ein möglichst hohes Wasserglas und füllen Sie es mit Leitungswasser. Geben Sie dann vorsichtig ein paar Löffel Zucker direkt auf den Boden des Glases. Nicht umrühren! Wenn Sie das Glas nun eine längere Zeit stehen lassen, bildet sich ein Dichtegradient aus. Unten im Glas ist die Zuckerlösung ziemlich konzentriert, oben im Glas ist sie dagegen noch sehr verdünnt. Das hängt mit der Brownschen Bewegung der Zuckerteilchen zusammen, es herrscht anfänglich ein extrem starker Konzentrationsgradient (unten viel Zucker, oben gar keiner), der nach einem Konzentrationsausgleich strebt.
Nachdem man die DNA-Probe auf diesen Dichtegradienten gegeben hat, zentrifugiert man das Reagenzglas mit einer sehr hohen Umdrehungsgeschwindigkeit. Dadurch wird die DNA-Probe in Richtung Reagenzglas-Boden gezogen. Während dieser Wanderung kommt die DNA in Regionen mit immer größerer Dichte. Irgendwann ist die Dichte der Cäsiumchlorid-Lösung genau so groß wie die Dichte der DNA-Probe. Ab hier sinkt die DNA-Probe nicht mehr weiter.
Wie könnte sie auch? Die DNA ist ja leichter als die jetzt unter ihr liegenden Schichten (und schwerer als die über ihr befindlichen Schichten). Ein Stück Holz können Sie zwar auch unter Wasser drücken, aber es kommt von selbst immer wieder hoch.
Kommen wir nun zum zweiten Versuch, im Bild rechts dargestellt. Hier hat man keine "normale" DNA-Probe auf den Dichtegradienten getan, sondern sogenannte "schwere DNA". Was versteht man darunter?
Aus dem Chemieunterricht der Stufe 8 oder 9 sollten Sie den Begriff Isotop kennen. Unter Isotopen versteht man Atome, die zwar die gleiche Anzahl an Protonen besitzen, aber eine unterschiedliche Anzahl an Neutronen.
Stickstoff-Atome haben meistens 7 Protonen und 7 Neutronen im Atomkern, daher haben sie die Atommasse 14, und man schreibt kurz 14N. Neben diesen "normalen" N-Atomen gibt es aber auch N-Atome, die ein zusätzliches Neutron im Kern haben. Diese Stickstoff-Isotope haben dann die Atommasse 15, und man bezeichnet sie als 15N oder als schweren Stickstoff.
Wenn man Bakterien nun auf einem Nährboden wachsen lässt, der solche 15N-Isotope enthält, dann bauen die Bakterien diese 15N-Atome auch in ihre DNA ein, wenn sich diese in der S-Phase des Zellzyklus verdoppelt. Und da 15N-Atome etwas schwerer sind als 14N-Atome, ist auch solche 15N-DNA etwas schwerer als die normale 14N-DNA.
Bei der Dichtegradientenzentrifugation sieht man diesen Unterschied deutlich. Die schwere 15N-DNA sinkt etwas weiter in Richtung Reagenzglas-Boden als die Probe mit normaler 14N-DNA.
Der eigentliche Versuch
Wir kommen nun zum eigentlichen Meselson-Stahl-Versuch. Die Forscher ließen Bakterien der Art Escherichia coli 14 Generationen lang auf einem 15N-Nährboden wachsen, der das Salz 15NH4Cl (Ammoniumchlorid) enthielt [2]. Die Bakterien bauten die schweren Stickstoff-Atome dann in die DNA-Basen ein. Nach 14 Generationen = 14 Zellteilungen = 14 DNA-Replikationen war die DNA der Bakterien mit 15N gesättigt, 14N-Atome kamen in der DNA nicht mehr vor.
Die aus den Bakterien isolierte DNA wurde dann einer Dichtegradientenzentrifugation unterzogen, das Ergebnis haben wir bereits in Abbildung 2 gesehen, und auch in der nächsten Abbildung ist dieser Versuch links noch einmal zu sehen:
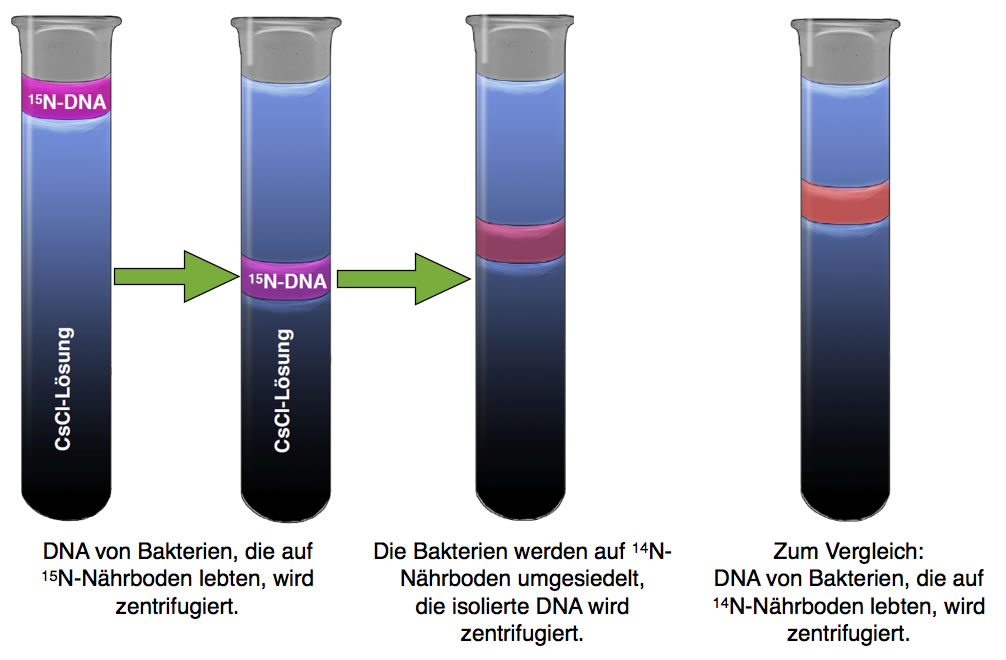
Ergebnis der Dichtegradientenzentrifugation bei konservativer Replikation
Autor: Ulrich Helmich, Lizenz: Public domain.
Nun geht der Versuch aber weiter. Nachdem die Bakterien für 14 Generationen [2] (Zellteilungen) auf dem Nährboden mit den 15N-Atomen wuchsen , hat man sie auf einen normalen Nährboden umgesetzt. Dieser Nährboden enthielt nicht nur 14NH4Cl als Salz, sondern auch 14N-haltige DNA-Nucleotide, also die DNA-Bausteine.
Ab jetzt konnten die Bakterien keine 15N-Atome mehr in ihre DNA einbauen, sondern nur noch die leichteren 14N-Atome, die ihnen im neuen Nährboden nur noch zur Verfügung standen.
Durch Zugabe bestimmter Chemikalien konnte man die Bakterien dazu bringen, dass sich alle gleichzeitig teilten. Man spricht hier von einer synchronen Zellteilung. Vor dieser Zellteilung wird die DNA der Bakterien verdoppelt, es findet also eine DNA-Replikation statt.
Nach der ersten synchronen Zellteilung wurde die DNA dieser Bakterien isoliert und wieder einer Dichtegradientenzentrifugation unterzogen.
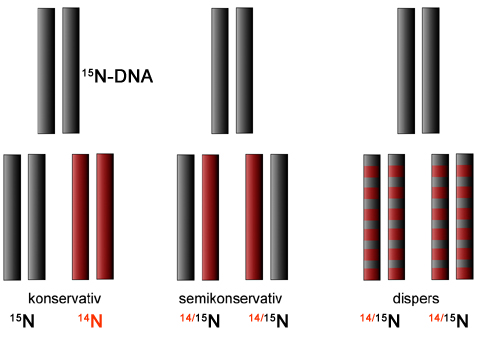
Erwartete Ergebnisse nach dem konservativen Mechanismus
Wenn sich die DNA nach dem konservativen Mechanismus verdoppelt, dann müsste man jetzt zwei verschiedene DNA-Banden in dem Reagenzglas erwarten. Nämlich eine Bande für die ursprüngliche und konservierte (unveränderte) 15N-DNA, und eine Bande für die neugebildete 14N-DNA:
Erklärung der Versuchsergebnisse
Autor: Ulrich Helmich, Lizenz: Public domain.
Tatsächliche Versuchsergebnisse
In den Reagenzgläsern fand man aber nur eine DNA-Bande. Diese Bande befand sich genau zwischen dem 14N-Bereich und dem 15N-Bereich, wie der Vergleich mit der Zentrifugation von 14N-DNA zeigt.
Es gibt genau zwei Erklärungen für dieses Ergebnis: Die DNA wird entweder semikonservativ oder dispers repliziert. Den konservativen Mechanismus konnte man nach diesen Versuch ausschließen, er hätte definitiv zwei Banden liefern müssen, eine bei 14N und eine bei 15N. Der disperse Mechanismus von Max Delbrück ist allerdings mit diesem Versuchsergebnis noch nicht ausgeschlossen.
Meselson und Stahl waren sicherlich sehr zufrieden mit diesen Ergebnissen, aber ganz zufrieden waren sie sicherlich nicht. Es gab ja immer noch zwei verschiedene Replikationsmechanismen, die in Frage kamen, der semikonservative und der disperse.
Was machten die beiden Forscher? Sie ließen die Bakterien nach der ersten Replikationsrunde noch weiter auf dem 14N-Nährboden wachsen. Nach einer zweiten Replikationsrunde isolierten sie wieder die DNA und unterwarfen sie einer Dichtegradientenzentrifugation.
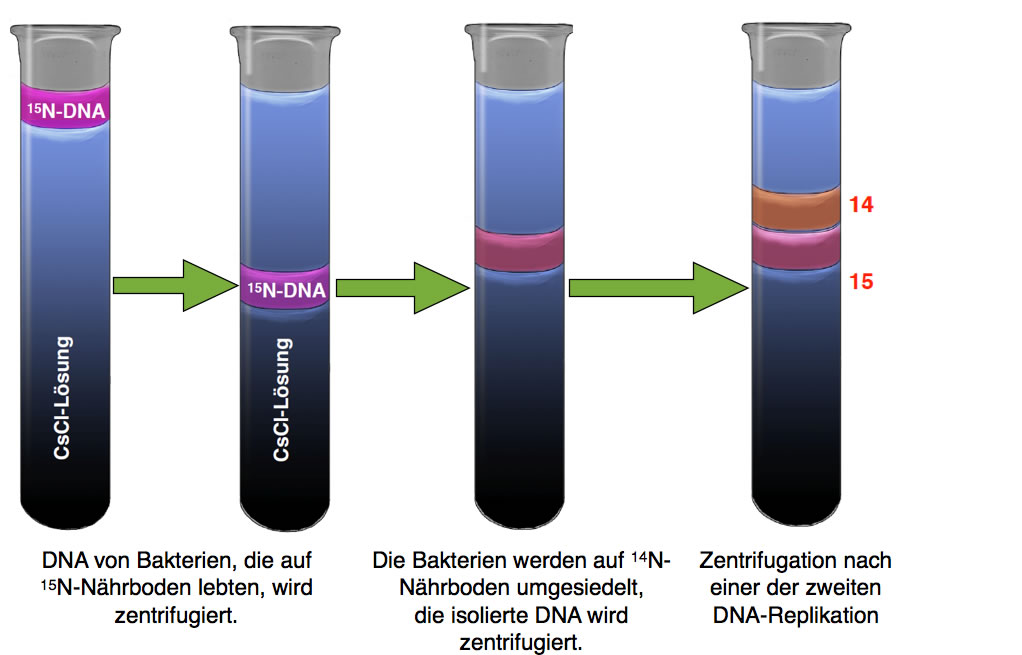
Ergebnis der Dichtegradientenzentrifugation nach zwei synchronen Teilung der Zellen
Autor: Ulrich Helmich, Lizenz: Public domain.
Jetzt fanden sie Forscher zwei Banden im Reagenzglas, eine zwischen 14 und 15, und eine im Bereich 14. Dieses Ergebnis konnte nicht mehr mit dem dispersen Mechanismus erklärt werden, wohl aber mit dem semikonservativen.
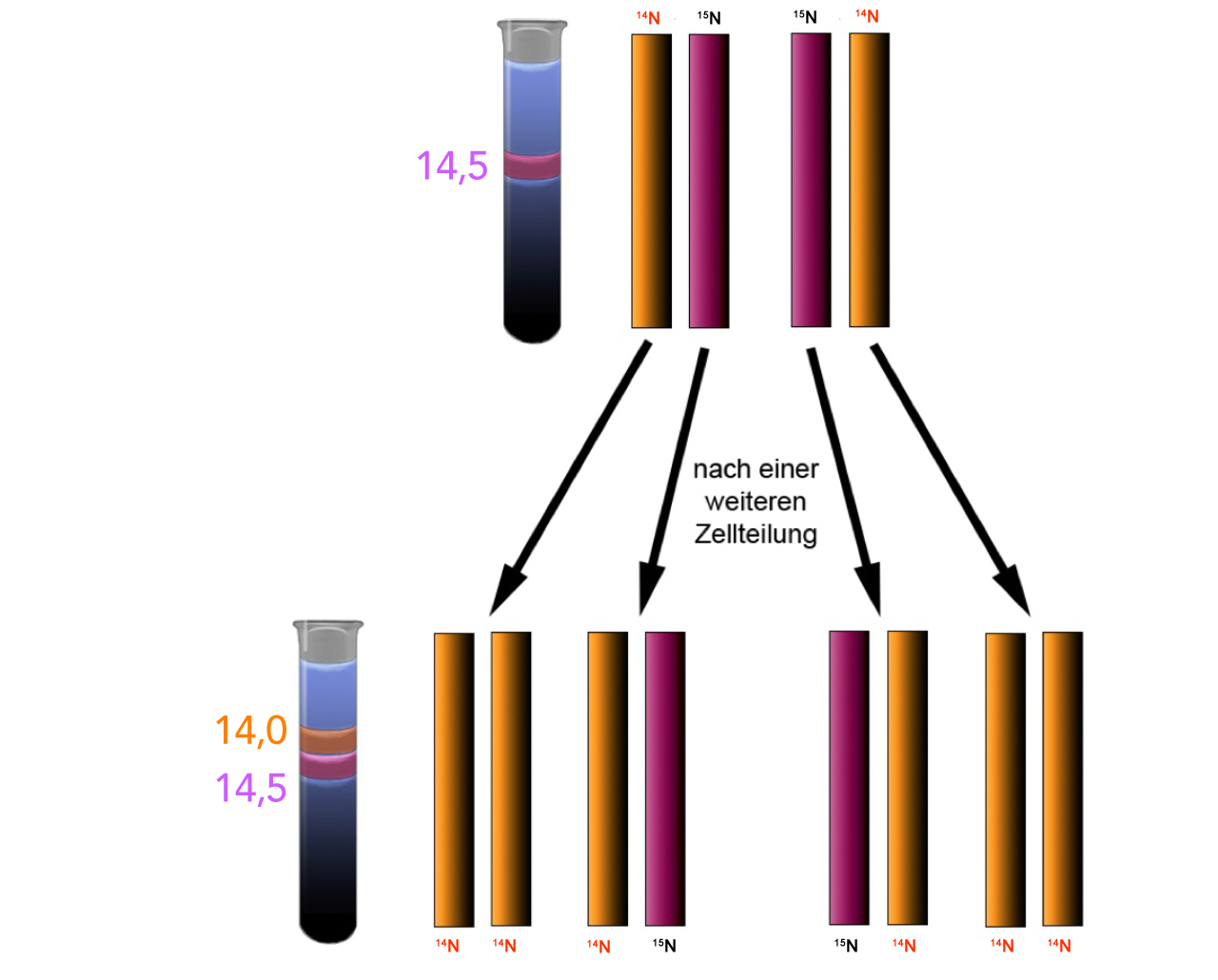
Die Erklärung der Versuchsergebnisse
Autor: Ulrich Helmich, Lizenz: Public domain.
Die letzte Abbildung zeigt noch einmal eine Erklärung dieses Versuchsergebnisses. Nach der ersten Replikationsrunde besteht die Bakterien-DNA zur Hälfte aus 14N-DNA und 15N-DNA. Nach der zweiten Replikationsrunde wurde der 14N-DNA-Strang mit 14N-Nucleotiden ergänzt, so dass der gesamte Doppelstrang nur noch 14N-Atome enthält. Aber auch der 15N-DNA-Strang wurde mit 14N-Nucleotiden ergänzt. Der so entstandene Doppelstrang besteht zur Hälfte aus 14N-DNA und zur Hälfte aus 15N-DNA.
Nach dem dispersen Mechanismus würden alle Tochterstränge grundsätzlich sowohl14N-DNA wie auch 15N-DNA enthalten, es dürfte also nur eine DNA-Bande im Reagenzglas zu sehen sein. Mit jeder neuen Zellteilung in 14N-Nährmedium würde die DNA allerdings immer mehr 14N-Atome enthalten und damit immer leichter werden.
Meselson und Stahl stellten also fest, dass die Art und Weise der DNA-Replikation genau der Vorhersage von Watson und Crick entspricht:
"The results of the present experiments are in exact accord with the expectations of the Watson-Crick model for DNA duplication". [2]
Noch ein Experiment
Allerdings wollten Meselson und Stahl ganz sicher gehen, bevor sie die Ergebnisse veröffentlichten. Daher machten sie noch einen weiteren Versuch. Nach der ersten DNA-Replikation in dem 14N-Nährmedium enthielt ja der alte (konservierte) DNA-Strang noch jede Menge 15N-Atome, während der neu dazugekommene DNA-Strang ausschließlich 14N-Atome enthielt. Im Dichtegradienten konnte man das ja daran erkennen, dass sich die DNA-Bande genau zwischen der 14er Markierung und der 15er Markierung stabilisierte.
DNA ist ein recht stabiles Molekül, eine Auftrennung der DNA-Doppelhelix in zwei Einzelstränge kostet relativ viel Energie. Diese Energie kann aber durch Erhitzen auf fast 100 ºC locker aufgebracht werden. Genau das machten Meselson und Stahl nun. Sie erhitzten die Hybrid-DNA mit 14N- und 15N-Atomen und zentrifugierten die so erhaltenen DNA-Einzelstränge.
Wenn der disperse Mechanismus zutraf, der ja noch nicht ausgeschlossen werden konnte, dann dürfte nur eine einzige Bande zwischen der 14er und der 15er Markierung auftreten, denn jeder DNA-Einzelstrang hätte ja 14N- und 15N-Atome.
Wenn aber der semikonservative Mechanismus zutraf, müssten sich während der Zentrifugation zwei Banden entwickeln: Eine Band bei der 14er Markierung, nämlich die neu-synthetisierte DNA, und eine zweite Bande bei der 15er-Markierung, nämlich die konservierte DNA.
Das Ergebnis war eindeutig: Es zeigten sich zwei Banden, eine im 14er Bereich und eine im 15er Bereich. Damit war endgültig durch zwei verschiedene Experimente bewiesen, dass die DNA semikonservativ repliziert wird, genau so, wie Watson und Crick es vorhergesagt hatten.

|
Das Ergebnis der Versuche war so überzeugend und wurden sofort von allen Biologen akzeptiert, als ob sie nur darauf gewartet hätten. Noch bevor Meselson und Stahl ihren Versuch in einer Zeitschrift veröffentlichen konnten, erschien bereits ein Genetik-Lehrbuch, in dem der Versuch beschrieben wurde [4]. Heute wird der Versuch von Meselson und Stahl in mehreren Veröffentlichungen als "eines der schönsten und einfachsten Experimente der Zellbiologie" bezeichnet [5].
➥Der Original-Artikel von Meselson und Stahl
Unter diesem Link finden Sie eine PDF-Datei mit dem Original-Artikel von Meselson und Stahl, der am 14. Mai 1958 veröffentlicht wurde. |
Das Taylor-Experiment
Bereits ein Jahr vor den Versuchen von Meselson und Stahl kam Herbert Taylor 1957 auf die Idee, die Chromosomen pflanzlicher Zellen (Wurzelzellen der von Bellevalia romana bzw. Römische Hyazinthe) radioaktiv zu markieren.
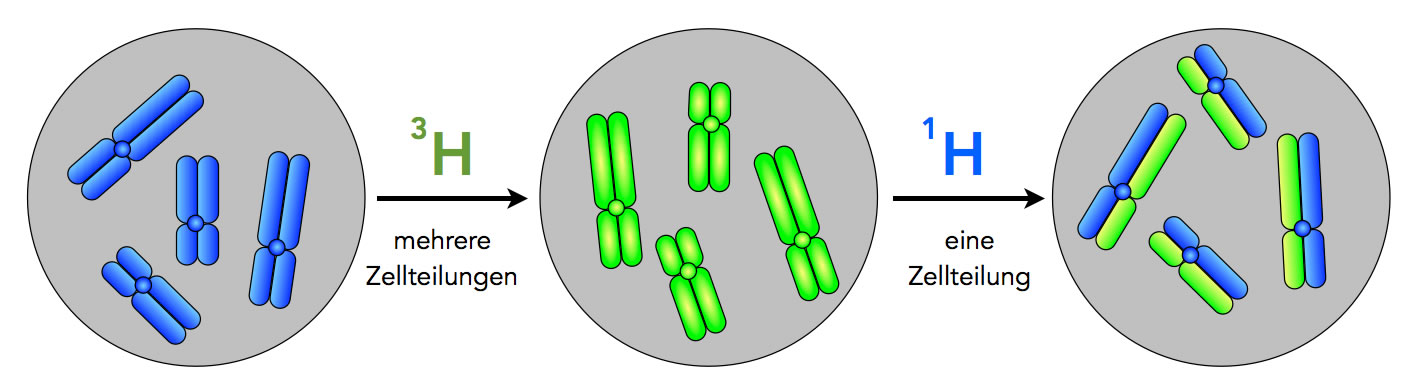
Stark schematische Darstellung des Taylor-Experiments
Autor: Ulrich Helmich 12/2024, Lizenz: Public domain
Bild A. Taylor ließ die Zellen zunächst auf einem Nährmedium wachsen, das mit radioaktivem Thymidin-Bausteinen versetzt war. Thymin ist ja eine der vier DNA-Basen, und Thymidin ist ein Nucleosid, besteht also aus einem Thymin-Molekül, das an ein Desoxyribose-Molekül gekoppelt ist. Die Thymidin-Moleküle waren mit dem radioaktivem Wasserstoff-Isotop 3H (Tritium) markiert. In der oberen Abbildung ist die radioaktive Strahlung durch die rote Farbe dargestellt.
Links im Bild (A) sehen wir ein derart markiertes 2-Chromatid-Chromosom, darunter sind vier solcher Chromosomen in einem Zellkern abgebildet.
Bild B. Die mit 3H radioaktiv markierten Zellen führten nun Zellteilungen durch. Direkt nach der erfolgten Mitose liegen 1-Chromatid-Chromosomen vor. Diese sind ebenfalls radioaktiv markiert und daher rot dargestellt.
Zur Erinnerung: Ein jedes Chromatid besteht aus zwei DNA-Strängen, die helixartig umeinander gewunden sind. Diese Windungen sind in der Abbildung nicht zu sehen, weil es sich ja um eine stark schematische Darstellung handelt.
Bild C. Die Zellen wurden nun in ein neues Nährmedium gebracht, das kein radioaktives Tritium 3H mehr enthielt, sondern nur noch das nicht-radioaktive normale Wasserstoff-Isotop 1H. In diesem neuen Nährmedium durchliefen die Zellen nun die S-Phase, in der die DNA-Replikation stattfindet.
Die neu eingebauten Nucleotide waren nicht mehr radioaktiv, was im Bild durch die blaue Farbe symbolisiert wird. Jedes 2-Chromatid-Chromosom bestand aus zwei DNA-Doppelhelices, von denen der eine Strang noch radioaktiv markiert war (rot gezeichnet), der andere, neu hinzugekommene Strang jedoch nicht mehr markiert war (blau gezeichnet). Oder wie Taylor selbst schreibt:
"After another duplication in the absence of labeled precursors each labeled chromatid (chromosome now) yields one labeled daughter and one free of label at any level along the length." [3]
Bei der mikroskopischen Betrachtung solcher 2-Chromatid-Chromosomen fällt auf, dass die Chromosomen nur noch "halb" markiert sind. In der Abbildung wird dies durch eine rot-blaue Mischfarbe (violett) dargestellt.
Bild D. Es fand erneut eine Mitose in 1H-Medium statt. Die so gebildeten 1-Chromatid-Chromosomen sind ebenfalls hybrid aufgebaut: Der eine DNA-Strang ist radioaktiv markiert, der andere nicht.
Bild E. Eine zweite S-Phase in dem 1H-Medium. Der radioaktive DNA-Strang wird durch einen neuen nicht-radioaktiven Strang komplettiert, der nicht-radioaktive Elternstrang wird durch einen zweiten nicht-radioaktiven Strang ergänzt.
Bei mikroskopischer Betrachtung kann man erkennen, dass die 2-Chromatid-Chromosomen aus zwei verschieden stark strahlenden Chromatiden bestehen. Das eine Chromatid strahlt noch halb so stark wie bei A), das andere Chromatid weist überhaupt keine Strahlung mehr auf.
Fazit
Die Ergebnisse von Taylor bestätigen nicht nur das semikonservative Modell der DNA-Replikation, sondern zeigen überdies, dass jedes Chromatid eines Chromosoms einen eigenen DNA-Doppelstrang besitzt. Zu Zeiten Taylors wurde der Aufbau der Chromatiden noch heftig diskutiert, einige Wissenschaftler nahmen an, dass sich mehrere DNA-Stränge in einem Chromatid befinden.
Schaut man sich die Originalarbeit von Taylor an, dann stellt man erstaunt fest, dass dieses Experiment eigentlich nur den kleineren Teil der Arbeit ausmacht. Den Hauptteil des Artikels nehmen die Mosaik-Chromosomen ein, die Taylor bei seinen Experimenten ebenfalls beobachtet hatte: Chromosomen, die an bestimmen Stellen radioaktiv markiert sind, aber an anderen Stellen nicht. Taylor zog daraus den Schluss, dass während der Zellteilungen die Chromatiden Genmaterial untereinander austauschen.
Quellen:
- Schulbücher der gymnasialen Oberstufe
- Jochen Graw: Genetik, 7. Auflage, Springer Spektrum, Berlin 2021.
- J. Herbert Taylor: "Sister Chromatid Exchanges in Tritium-labeled Chromosomes", in Genetics 1958 May; 43(3): 515–529.
- Alberts, Bruce et al. Lehrbuch der Molekularen Zellbiologie, 5. Auflage, Weinheim 2021.
- Helmut Plattner: Abenteuer Zellbiologie - Streifzüge durch die Geschichte, Springer Spektrum Berlin 2021.
Seitenanfang -
Weiter mit Details zum Replikationsvorgang (Grundwissen - Vertiefungswissen - Expertenwissen)...