Organische Radikale entstehen, wenn in einem Molekül ein ungepaartes Elektron gebildet wird. Dies kann auf unterschiedliche Weise geschehen, die im Folgenden systematisch dargestellt werden.
1. Homolytische Bindungsspaltung
Einer der bekanntesten Wege ist die homolytische Spaltung einer kovalenten Bindung. Dazu muss die Bindungsdissoziationsenergie dieser kovalenten Bindung überwunden werden, was oft den Einsatz von Wärmeenergie oder Lichtenergie erfordert (Thermolyse bzw. Photolyse).

Photolytische Spaltung eines Brom-Moleküls in zwei Brom-Radikale
Die Abbildung 2 zeigt die Startreaktion der Bromierung eines Alkans. Siehe dazu auch "Radikalische Substitution" auf dieser Homepage.
1.1 Thermolyse
Durch die Zufuhr von thermischer Energie (Wärmeenergie) geraten die kovalenten Bindungen zwischen den Atomen einer organischen Verbindung in Schwingungen. Wird genug Energie zugeführt, können diese Bindungen aufbrechen. Je geringer die Bindungsdissoziationsenergie zwischen den Atomen, desto leichter brechen solche Bindungen auf. Vor allem Peroxide und Azoverbindungen können leicht thermolytisch in Radikale gespalten werden.
Peroxide: Die O-O-Bindung ist sehr schwach. Ein bekanntes Beispiel ist das Dibenzoylperoxid, das oft als Radikalstarter bei der Herstellung von Polymeren verwendet wird.
Azoverbindungen: Diese Verbindungen mit zwei N-Atomen zerfallen unter Wärmeabgabe in ein stabiles Stickstoff-Molekül N2 und zwei organische Radikale.
1.2 Photolyse
Lichtquanten (Photonen) besitzen oft genug Energie, um kovalente Bindungen zu spalten. Je kurzwelliger das Licht, desto eher gelingt dies. Vor allem UV-Licht kann zur Photolyse verwendet werden. Bei der Reaktion von Brom mit Hexan kann man bereits im einfachen Schulversuch zeigen, dass die Radikalische Substitution im Blaulicht deutlich schneller verläuft als bei gleicher Lichtintensität im Gelb- oder Rotlicht.
1.3 Radiolyse
Bei der Radiolyse wird die kovalente Bindung durch hochenergetische, ionisierende Strahlung (zum Beispiel Röntgen- oder Gammastrahlung) aufgebrochen. Dies ist oft unspezifisch und führt in biologischen Systemen zur Bildung von freien Radikalen aus Wasser (OH-Radikale), die dann organische Moleküle (DNA, Proteine) angreifen.
2. Radikalbildung durch Redoxreaktionen
Auch durch die Übertragung eines einzelnen Elektrons (Single Electron Transfer SET) können Radikale entstehen.
2.1 Oxidation
Ein neutrales Molekül mit einem freien Elektronenpaar kann ein Elektron an einen geeigneten Akzeptor abgeben, dabei entsteht dann ein Kation, das gleichzeitig ein Radikal ist.
Bei der Kolbe-Elektrolyse wird der COOH-Gruppe einer Carbonsäure am Pluspol ein Elektron entzogen. Zunächst entsteht dabei ein instabiles Carboxyl-Radikal. Unter Abspaltung von CO2 (eine sehr stabile Verbindung) bildet sich dann ein Alkyl-Radikal. Aus Essigsäure lässt sich so beispielsweise ein Methyl-Radikal gewinnen.
2.2 Reduktion
Ein neutrales Molekül nimmt ein Elektron von einem geeigneten Elektronendonator auf. Gut geeignet als Donatoren sind Alkalimetalle wie Natrium oder Lithium.
3. Folgereaktionen der Radikalbildung
3.1 Abstraktion
Stößt ein Radikal auf ein Molekül, so kann es diesem Molekül ein Atom samt einem Elektron entziehen. Das Radikal verbindet sich dann kovalent mit diesem Atom. Ein bekanntes Beispiel für diese Abstraktionen (so nennt man das Entziehen eines Atoms aus einem Molekül) sind die Kettenfortpflanzungsschritte der Radikalischen Substitution. Als Ergebnis dieser Abstraktion entsteht dann ein neues Radikal.

Ein Brom-Radikal abstrahiert ein Wasserstoff-Atom aus einem Methan-Molekül. Dabei entsteht ein Methyl-Radikal.
3.2 Addition eines Radikals
Ein Radikal kann sich an eine Doppelbindung addieren, beispielsweise an eine C=C-Doppelbindung, wie im folgenden Beispiel gezeigt:
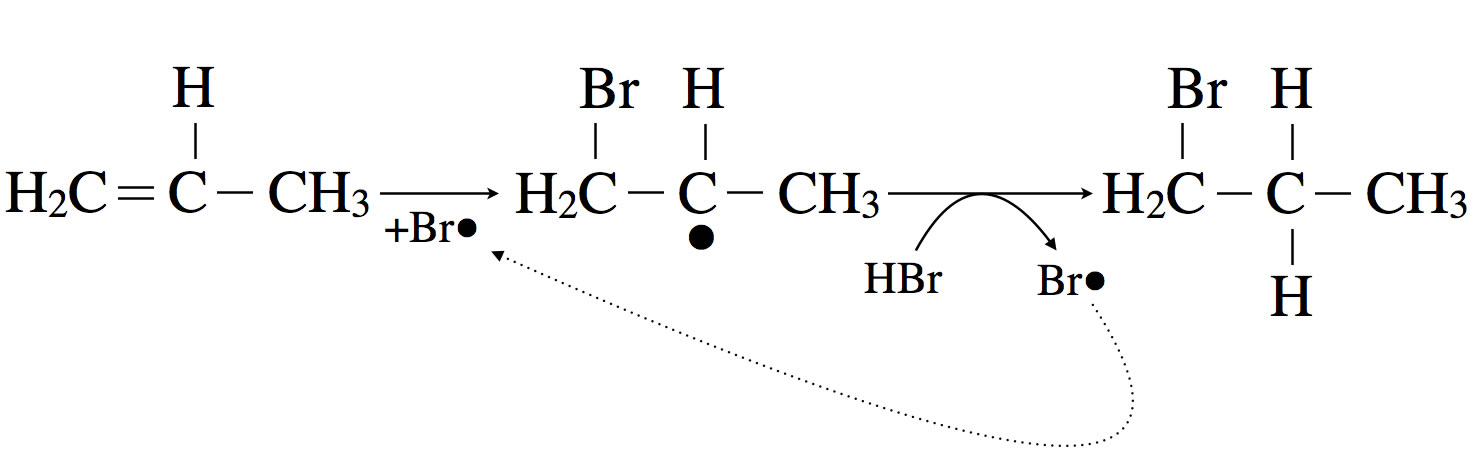
Hydrobromierung von Propen
Dabei entsteht dann ein neues Radikal, das weitere Reaktionen eingehen kann.
Bei der Hydrobromierung von Propen addiert sich zunächst ein Brom-Radikal an die C=C-Doppelbindung. Dabei entsteht ein Propyl-Radikal. In einem zweiten Schritt abstrahiert das Propyl-Radikal ein H-Atom aus einem HBr-Molekül.
3.3 Eliminierung
Ein Radikal kann durch Eliminierung eines thermodynamisch stabilen Moleküls wie CO2 oder N2 in ein stabileres Radikal überführt werden. Dabei entsteht kein Radikal neu, sondern ein bereits vorhandenes Radikal wird umgewandelt.
Beispiel Kolbe-Synthese
Ein typischer Fall ist die Bildung von Alkylradikalen bei der Kolbe-Synthese. Durch Abspaltung eines einzelnen Elektrons (Single Elektron Transfer SET) wird das Carboxylat-Ion R-COO--Gruppe einer Carbonsäure zunächst zu einem Carboxyl-Radikal R-COO•. Diese Radikalbildung gehört zum Punkt 2.1 - Radikalbildung durch Oxidation. Der nächste Schritt ist dann aber die Abgabe eines CO2-Moleküls (Eliminierung), so dass ein etwas stabileres Alkylradikal R• entsteht.
Beispiel AIBN
Bei Azoverbindungen liegt eine N=N-Bindung im Molekül vor. Diese Bindung ist relativ schwach und kann leicht thermolytisch gespalten werden (siehe Punkt 1.1).
Aus einer Azoverbindung R-N=N-R entstehen dann zunächst zwei Amino-Radikale:
R-N=N-R → 2 R-N•
Diese Amino-Radikale sind sehr instabil und zerfallen unter Abgabe von Stickstoff N2:
2 R-N• → 2 R• + N2
In der technischen Chemie wird hierzu meistens die Verbindung AIBN (Azobisisobutyronitril) eingesetzt.
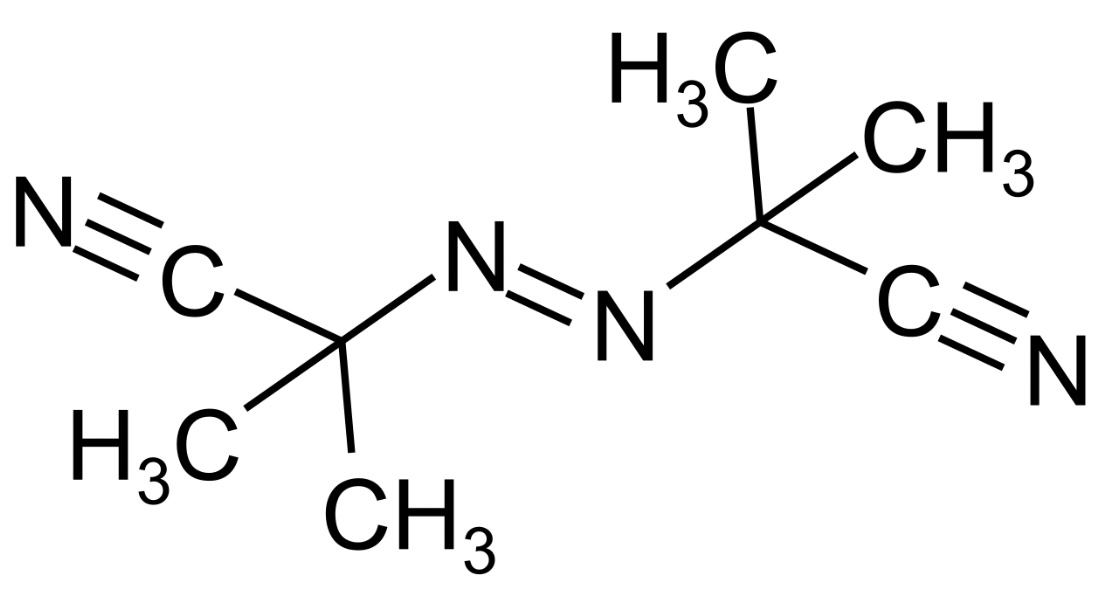
Azobisisobutyronitril
Quelle: Wikipedia, Lizenz: Public domain (da nur einfache Strukturformel).
Quellen:
- Falbe, J.; Regitz, M. (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- engl. Wikipedia, Artikel DPPH, Zugriff am 04.02.2019
- Vollhardt, K. P. C.; Schore, N. E.: Organische Chemie. 6. Auflage. Weinheim: Wiley-VCH, 2020.
- Wikipedia, Artikel Einelektronenübertragung, Zugriff am 04.02.2019
- Clayden, J.; Greeves, N.; Warren, S.: Organische Chemie. Berlin: Springer-Spektrum, 2013.