Ein typischer Aspekt einer chemischen Reaktion und sogar ein Basiskonzept der Chemie ist die Energieumsetzung bzw. das Energiekonzept. Eine chemische Reaktion kann exotherm oder endotherm sein, was man gut durch ein Energiediagramm veranschaulichen kann.
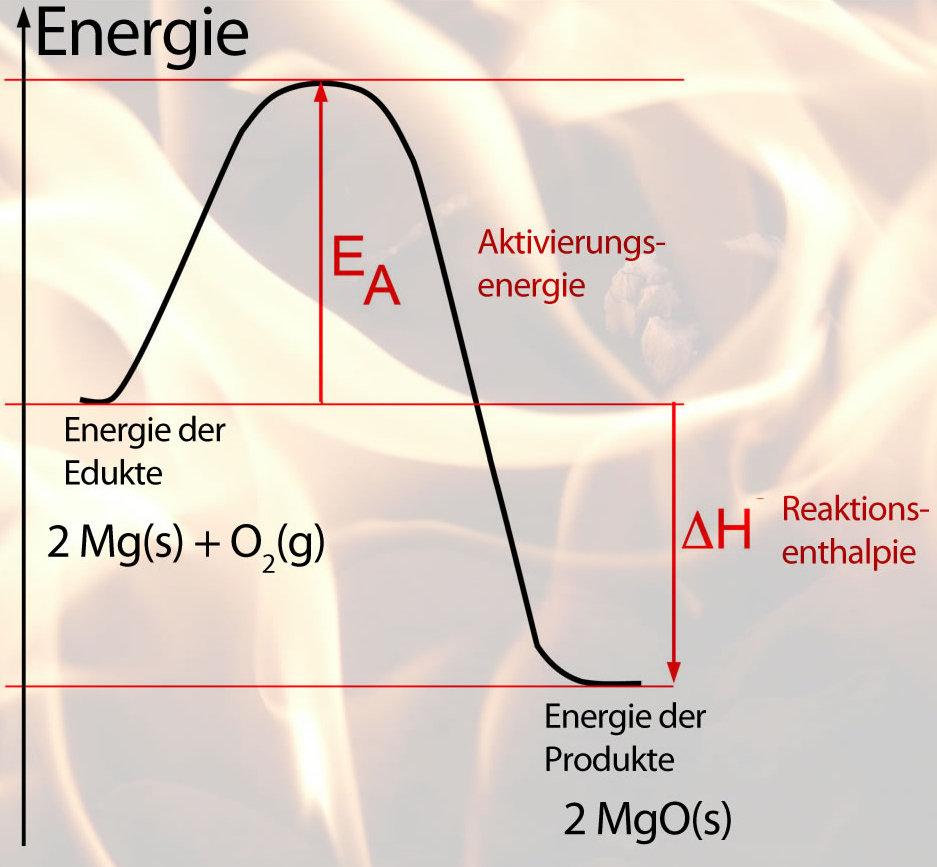
Energiediagramm der Oxidation von Magnesium
Autor: Ulrich Helmich 2017, Lizenz: Public domain
In der Abbildung sehen wir ein Energiediagramm zur Oxidation von Magnesium. Magnesium und Sauerstoff haben eine gewisse "innere Energie", die man direkt aber nicht messen kann.
Wenn wir das Magnesium jetzt mit dem Brenner erhitzen, wird es immer wärmer, die innere Energie des Magnesiums und des umgebenden Sauerstoffs nimmt dabei stark zu. Schließlich ist ein Punkt erreicht, an dem die Magnesium-Atome im gasförmigen Zustand vorliegen und mit den Sauerstoff-Molekülen zu Magnesiumoxid reagieren können.
Wenn sich Magnesium-Teilchen und Sauerstoff-Teilchen zu MgO zusammenschließen, wird sehr viel Energie freigesetzt; die innere Energie des Systems nimmt wieder ab. Bei einer exothermen Reaktion, wie sie in Abbildung 1 gezeigt ist, sinkt die innere Energie der Reaktionsprodukte sogar unter den Wert der Ausgangsstoffe.
Als Aktivierungsenergie bezeichnet man die Energie, die in die Ausgangsstoffe "hineingesteckt" werden muss, damit die Atome der Ausgangsstoffe miteinander reagieren. Als Reaktionsenergie oder Reaktionsenthalpie bezeichnet man die Differenz zwischen der inneren Energie der Reaktionsprodukte und der inneren Energie der Ausgangsstoffe. Bei einer exothermen Reaktion ist diese Differenz immer negativ, bei einer endothermen Reaktion ist die Reaktionsenergie dagegen positiv.
Veranschaulichung mit einem einfachen Zahlenbeispiel
Das kann man sich mit einem Zahlenbeispiel leicht klarmachen.
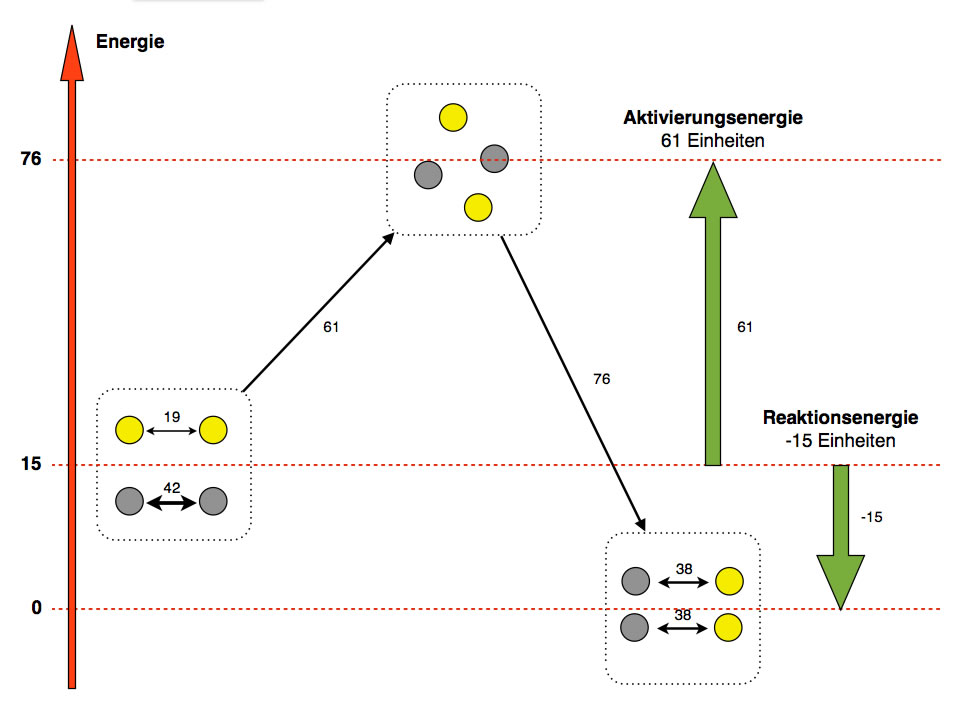
Ein willkürliches Zahlenbeispiel für eine exotherme Reaktion
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Zwei Eisen-Atome in diesem Beispiel ziehen sich mit 42 Einheiten an, zwei Schwefel-Atome mit 19 Einheiten (willkürlich gewählte Zahlen, die nichts mit der Wirklichkeit zu tun haben, aber das Ganze veranschaulichen sollen). Zur Trennung dieser vier Atome muss man also insgesamt 61 Energieeinheiten zuführen. Das ist in dem Beispiel die Aktivierungsenergie.
Die innere Energie der Ausgangsstoffe hat dadurch stark zugenommen, sie ist von 15 auf 76 gestiegen (der Wert 15 wurde ebenfalls rein willkürlich gewählt). Durch die Entstehung von zwei Fe-S-Bindungen wird aber jetzt ein großer Betrag an Energie freigesetzt, nämlich 76 Einheiten. Das liegt daran, dass die beiden Fe-S-Bindungen zusammen energiereicher sind als die Fe-Fe- und die S-S-Bindungen bei den Ausgangsstoffen. Die innere Energie des Systems sinkt dadurch um 76 Einheiten. Die Endprodukte haben also eine innere Energie, die 15 Einheiten unter der inneren Energie der Ausgangsstoffe liegt.
Zahlenbeispiel aus der Organischen Chemie
Das einfache Zahlenbeispiel ist hauptsächlich für Schüler und Schülerinnen der Sekundarstufe 1 interessant. Für ein echtes Zahlenbeispiel schauen wir uns mal die Bindungsenergien von verschiedenen Atombindungen an.
| Bindung | Mittlere Bindungsenergie in kJ/mol |
| C-C | 345 |
| C-H | 416 |
| C=O | 708 |
| O-H | 463 |
| O=O | 498 |
Quelle: https://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_Enthalpie_und_Bindungsenergie
Nun wollen wir aus diesen Zahlen die Reaktionsenergie der Verbrennung von Ethan berechnen. Ethan reagiert mit Sauerstoff nach folgender Gleichung:
$C_{2}H_{6} + 2 \frac{1}{2} O_{2} \to 2 CO_{2} + 3 H_{2}O$
Zum Aufbrechen der C-C-Einfachbindung benötigen wir 345 kJ/mol, zum Aufbrechen der sechs C-H-Bindungen 6 * 416 kJ/mol, und zum Aufbrechen der 2,5 O=O-Bindungen 2,5 * 498 kJ/mol. Wenn wir das zusammenrechnen, sind das 4086 kJ/mol.
Es entstehen aber vier C=O-Bindungen mit je 708 kJ/mol und sechs O-H-Bindungen mit je 463 kJ/mol. Wenn wir diese Beträge addieren, erhalten wir einen Wert von 5610 kJ/mol. Das sind 1524 kJ/mol mehr. Die Reaktionsenergie der Ethan-Oxidation sollte also -1524 mol/l betragen. Diese Zahlen können wir jetzt auch in einem "echten" Energiediagramm darstellen:
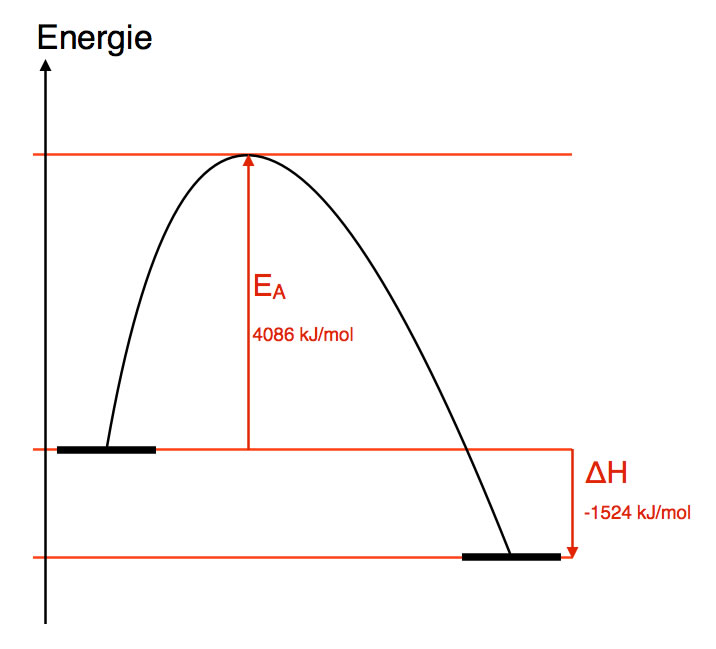
Energiediagramm der Verbrennung von Ethan
Autor: Ulrich Helmich 2017, Lizenz: Public domain