Bei diesem Reaktionsmechanismus handelt es sich um eine nucleophile Substitution, die an der COOH- bzw. COX-Gruppe von Carbonsäuren bzw. Carbonsäure-Derivaten stattfindet.
Die nucleophile Substitution an diesen Verbindungen läuft nicht nach dem von den Halogenalkanen oder Alkoholen bekannten SN1- oder SN2-Mechanismus ab; hier noch einmal zur Erinnerung:

Der SN1- und der SN2-Mechanismus im Vergleich
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Beim SN1-Mechanismus spaltet sich im ersten Schritt das Nucleofug ab, zurück bleibt als Zwischenprodukt ein planares Carbenium-Ion. Im zweiten Schritt wird dieses Carbenium-Ion von dem Nucleophil Y- angegriffen. Bei symmetrischen Verbindungen erfolgt dieser nucleophile Angriff von jeder Seite mit gleicher Wahrscheinlichkeit, so dass ein Gemisch aus den beiden Stereoisomeren entsteht.
Der A/E-Mechanismus
Vergleichen wir diese beiden Mechanismen der nucleophilen Substitution nun mit dem für Carbonsäuren und ihren Derivaten typischen Additions-Eliminierungs-Mechanismus:
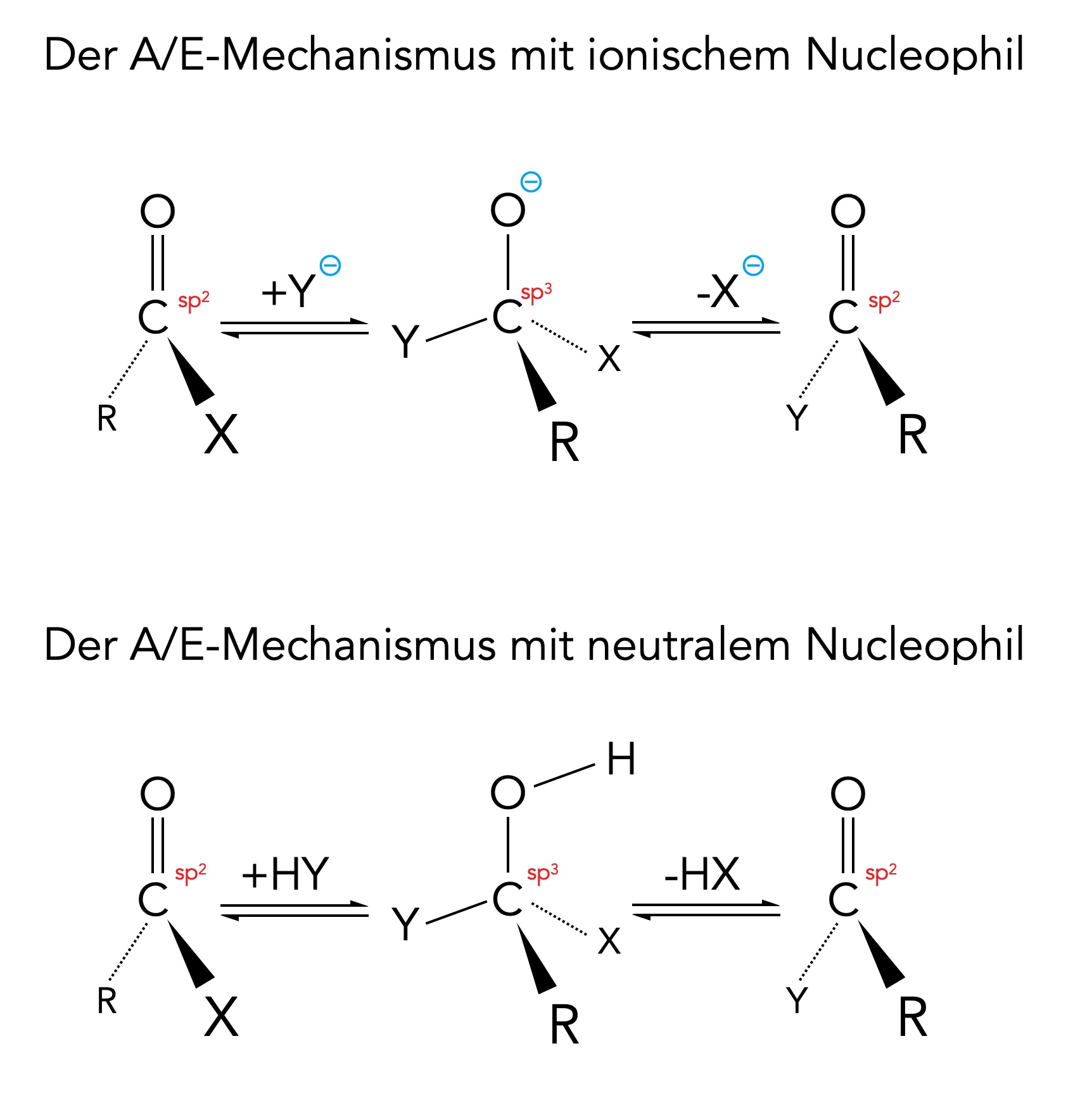
Der Additions-Eliminierungs-Mechanismus
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Die Abbildung zeigt einmal den A/E-Mechanismus mit einem ionischen Nucleophil und einmal mit einem neutralen Nucleophil.
Im ersten Reaktionsschritt addiert sich das Nucleophil Y- oder HY an das positiv polarisierte C-Atom der COX-Gruppe (X = Nucleofug). Dabei entsteht eine sp3-hybridisierte tetraedrische Zwischenstufe.
Bei einem ionischen Nucleophil übernimmt das O-Atom der COX-Gruppe die negative Ladung, bei einem neutralen Nucleophil übernimmt das O-Atom das mitgebrachte H-Atom.
Im zweiten Reaktionsschritt spaltet sich dann das Nucleofug ab, entweder als X- oder als HX. Die C=O-Doppelbindung bildet sich zurück, und das C-Atom liegt wieder im sp2-hybridisierten Zustand vor.
Dieser A/E-Mechanismus läuft bei Carbonsäuren mit ihrer COOH-Gruppe nicht besonders gut ab, aber auf jeden Fall schneller als ein nucleophiler Additionsmechanismus. Carbonsäure-Derivate reagieren da wesentlich schneller, vor allem die Carbonsäure-Chloride.
Bei Carbonsäuren kann man die Reaktion aber durch einen sauren oder basischen Katalysator erheblich beschleunigen.
Der basisch katalysierte A/E-Mechanismus

Basenkatalysierter A/E-Mechanismus
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
- Der erste Schritt besteht in der Bildung des ionischen Nucleophils Y- mit Hilfe einer Base B-.
- Im zweiten Schritt findet die eigentliche A/E-Reaktion statt, wie wir sie bereits eben beschrieben haben.
- Im dritten Schritt wird der basische Katalysator B- zurückgebildet.
Der sauer katalysierte A/E-Mechanismus
Der säurekatalysierte Additions-Eliminierungs-Mechanismus läuft etwas komplizierter ab:

Basenkatalysierter A/E-Mechanismus
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
- Im ersten Schritt lagert sich ein Proton an die COX-Gruppe an, und zwar an das elektronegative O-Atom. Das ionische Zwischenprodukt ist mesomeriestabilisiert, bei der einen Grenzstruktur ist das C-Atom positiv geladen, ist also ein Carbenium-Ion. Dadurch wird der elektrophile Charakter dieses C-Atoms stark gesteigert, so dass Nucleophile leichter angreifen können.
- Im zweiten Schritt addiert sich das neutrale Nucleophil HY an dieses Carbenium-Ion, es entsteht ein instabiles Zwischenprodukt mit einer positiv geladenen Y-H-Gruppe. Das Proton kann sich dann umlagern, so dass eine positiv geladene X-H-Gruppe gebildet wird.
- Im dritten Schritt wird das Nucleofug HX abgespalten (eliminiert), und es bildet sich ein sp2-hybridisiertes positiv geladenes Zwischenprodukt, das wieder mesomeriestabilisiert ist.
- Im vierten Schritt schließlich wird das Proton zurückgebildet, und das sp2-hybridisierte Endprodukt liegt vor.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.
- K. P. C. VollhardT, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.