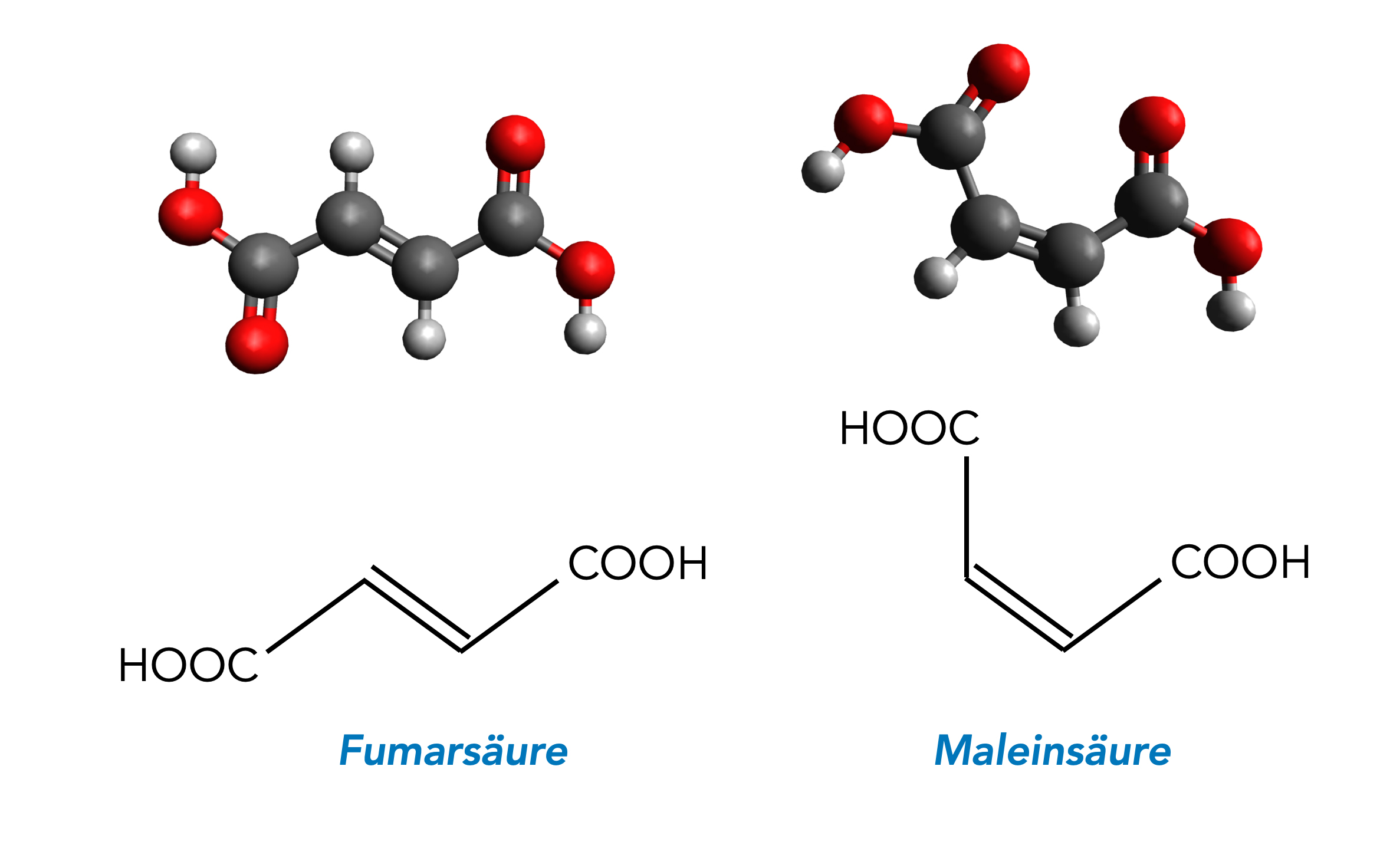
In dieser NRW-Abituraufgabe aus dem Jahre 20130 (LK) geht es um die beiden ungesättigten Dicarbonsäuren Fumarsäure und Maleinsäure.
Auf dieser Seite finden Sie die Strukturformeln, Molekülmodelle sowie ein paar interessante Informationen zu diesen beiden Säuren.
Ich will hier nicht auf die komplette Aufgabe eingehen, sondern einen Punkt herauspicken, der mir besonders interessant vorkommt:
| pKS-Werte | Fumarsäure | Maleinsäure |
| erster pKS-Wert | 3,0 | 1,9 |
| zweiter pKS-Wert | 4,5 | 6,5 |
Bei der Abgabe des ersten Protons ist die Maleinsäure ungefähr 10 mal so stark wie die Fumarsäure. Bei der Abgabe des zweiten Protons verhält sich die Sache aber genau umgekehrt. Die Fumarsäure gibt ihr zweites Proton ungefähr 100 mal so leicht ab wie die Maleinsäure.
Wie kann man dieses Phänomen erklären?
Text
Autor: Ulrich Helmich, Lizenz: Public domain
Die Erklärung liegt in der Tatsache begründet, dass sich die beiden COOH-Gruppen in der Maleinsäure so nahe stehen, dass sie H-Brücken untereinander ausbilden können. Dies stabilisiert das einfach negativ geladene Anion der Maleinsäure und erklärt den stärkeren Säurecharakter.
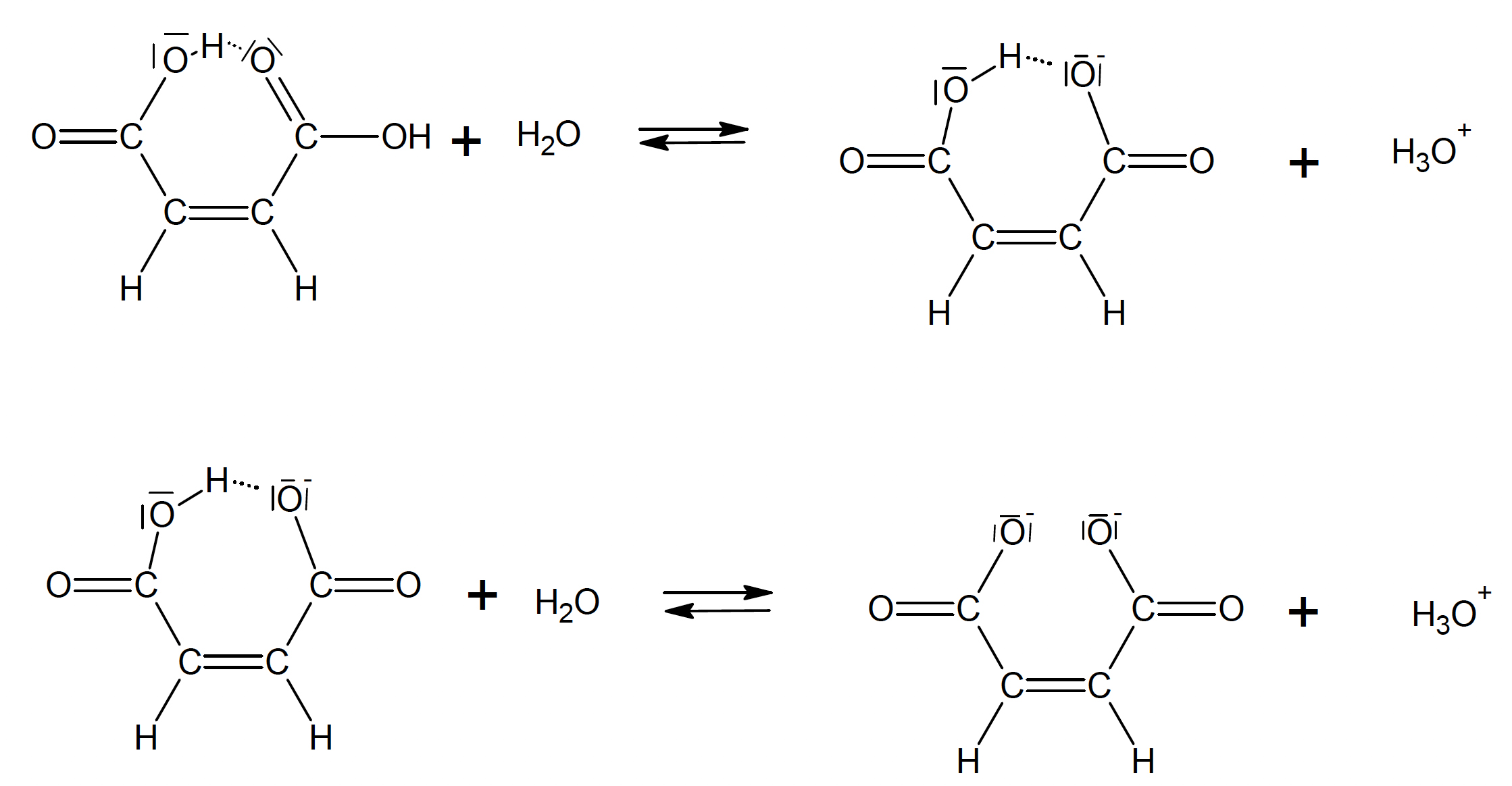
Mesomeriestabilisierung des Maleinsäure-Monoanions
keine Lizenz, da geringe Schöpfungshöhe
In der oberen Reihe sieht man die Bildung des Monoanions der Maleinsäure. Das einfach negativ geladene O-Atom bildet eine H-Brücke mit dem H-Atom der zweiten COOH-Gruppe und wird dadurch stabilsiert. Bei der Fumarsäure kann das nicht passieren, weil die zweite COOH-Gruppe zu weit entfernt ist. Daher kann das erste Proton der Maleinsäure relativ leicht abgegeben werden, was bei der Fumarsäure deutlich schwerer ist.
In der unteren Reihe sieht man die Bildung des Dianions der Maleinsäure. Nun ist es die eben erwähnte H-Brücke, die diesen Reaktionsschritt schwieriger macht. Um das Dianion zu bilden, müsste die stabilisierende H-Brücke gelöst werden, was energetisch nicht so günstig ist. Daher wird das zweite Proton bei der Fumarsäure leichter abgegeben als bei der Maleinsäujre.