In dieser NRW-Abituraufgabe aus dem Jahre 2009 (Grundkurs) geht es um die industrielle Verarbeitung des C4-Raffinats, eines Gemischs aus Buten- und Butan-Isomeren, wie es beim Cracken von Erdöl anfällt.
Die Aufgabe
Material:
Betrachten wir zunächst kurz das vorgegebene Material, das im NRW-Abitur als "fachspezifische Vorgaben" bezeichnet wird. Am Anfang steht eine Tabelle, in der die Komponenten des C4-Raffinats aufgelistet sind, auch die Siedepunkte der Verbindungen sind angegeben. Hier kann man schon sehen, dass die Siedepunkte recht eng beieinander liegen, so dass eine Auftrennung der Komponenten durch Destillation so gut wie nicht möglich ist. Also muss man zu chemischen Methoden greifen.
Im ersten Schritt behandelt man das Raffinat mit Schwefelsäure. Da die Komponente 2-Methyl-propen wegen ihres sek. C-Atoms sehr reaktiv gegenüber Schwefelsäure ist, reagiert sie am stärksten und es bildet sich das Zwischenprodukt tert-Butylhydrogensulfat, das leicht abgetrennt werden kann. Aus diesem Zwischenprodukt kann dann leicht 2-Methyl-propan-2-ol entstehen, der zunächst abdestilliert und dann wieder zu 2-Methyl-propen umgesetzt wird. Auf diese chemische Weise konnte man quasi das 2-Methyl-propen aus dem C4-Raffinat isolieren. Diese Verbindung wird dann als Ausgangsstoff zum Beispiel für die Herstellung von Polyisobuten verwendet.
Im zweiten Trennschritt behandelt man die restlichen C4-Verbindungen unter "verschärften Bedingungen" mit Schwefelsäure. Die verbliebenen Buten-Isomere reagieren dann zu sec-Butylhydrogensulfat, das dann mit Wasser zu Butan-2-ol reagiert. Das Restgas enthält dann die C4-Alkane.
Aus dem Butan-2-ol wird dann Butanon synthetisiert, als Nebenprodukt entsteht Wasserstoff, das hier als "Gas, das in einer Knallgasprobe reagiert", bezeichnet wird.
Aufgabenstellung:
Welche Aufgaben wurden nun im Jahre 2009 gestellt? Schauen wir uns die Aufgabenstellung mal kurz an.
Aufgabe 1
Die S. sollen hier die im Text erläuterten chemischen Trennverfahren schematisch darstellen, und zwar als "Produktschema". In den Zusatzinformationen findet sich ein kleines Beispiel für ein solches Produktschema. Dann kommt eine sehr simple Aufgabe: Sie S. sollen die Vorteile von Katalysatoren erläutern.
Aufgabe 2
Hier kommt die "eigentliche" Chemie-Aufgabe, wie ich sie selbst auch liebe. Die S. sollen die Reaktionsgleichungen für die chemische Auftrennung des C4-Raffinations formulieren.
Aufgabe 3
Hier geht es hauptsächlich um Lernstoff aus der Stufe EF, nämlich um Oxidationszahlen. Die S. sollen begründen - mit Hilfe von Oxidationszahlen - wieso die Butanon-Synthese aus Butan-2-ol eine Oxidation ist. Außerdem sollen sie eine Reaktionsgleichung für die Verbrennung von Butanon aufstellen und - jetzt kommt es - zwei Sicherheitshinweise für den Umgang mit Butanon entwickeln.
Erwartungen
Aufgabe 1
Hier ein Produkt-Schema, das wahrscheinlich schon über den Erwartungen liegt:
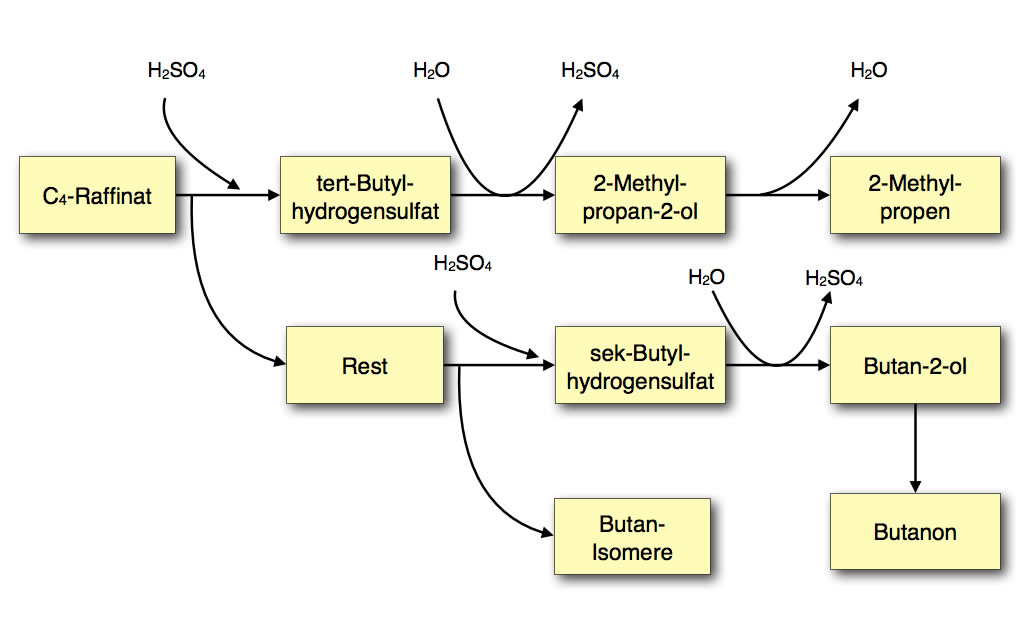
Alternative Darstellungen sind laut offizieller Vorgaben ebenfalls erlaubt.
Als "Vorteile von Katalysatoren" sollen vor allem ökonomische genannt werden. In den Erwartungen steht nichts davon, dass zum Beispiel Katalysatoren die Aktivierungenergie senken und so die Reaktionsgeschwindigkeit erhöhen, geschweige denn, dass der genaue Mechanismus eines Katalysators erläutert werden soll. Es reichen die Erwähnung von Aspekten wie "Einsparung von Energie" oder "Umsatzsteigerung pro Zeiteinheit". Im Grunde muss man also keine Ahnung von Chemie haben, wenn man diese Teilaufgabe korrekt lösen will. Auch zur Aufstellung des Produkt-Schemas reichen schon sehr geringe Chemie-Kenntnisse aus, man muss lediglich den vorgegebenen Text genau lesen und auswerten.
Aufgabe 2
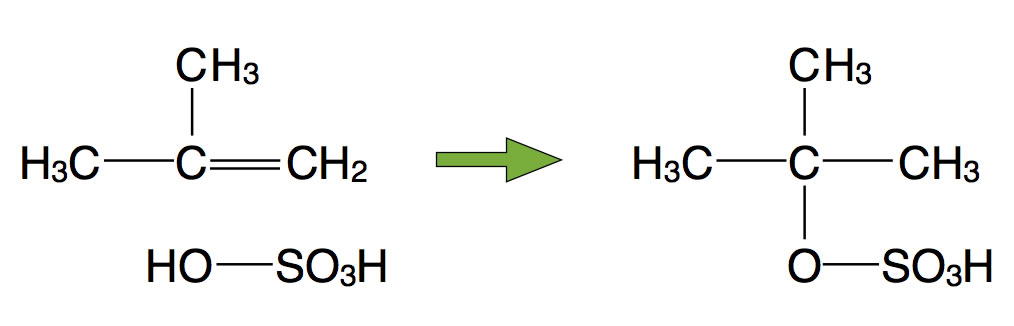
Hier handelt es sich um eine klassische elektrophile Addition, bei der die Markownikow-Regel eine Rolle spielt, deren Erwähnung allerdings nicht verlangt wird. Es entsteht das stabile tertiäre Carbenium-Ion, das durch die drei Methylgruppen stabilisiert wird (+I-Effekt).
Meine Güte, das ist ja fast so wie bei der Aufgabe von 2007, auch hier bildete sich ein tertiäres Carbenium-Ion, und auch hier sollten die Schüler die Stabilität mit positiven induktiven Effekten begründen. Irgendwie wiederholen sich die Aufgaben doch...
Bei dieser Aufgabe wird erwartet, dass man tatsächlich mit dem Kohlenmonoxid und dem Natrium beginnt:
$NaOH + CO \to HCOONa $
Das Natriummethanoat wird dann mit einer Säure zu Ameisensäure umgesetzt:
$HCOONa + HA \to HCOOH + NaA$
Dabei ist HA eine Säure mit A als Säure-Anion. Bei dieser Reaktion handelt es sich um eine Säure-Base-Reaktion, bei der die stärkere Säure HA ein Proton an den Säurerest der schwächeren Säure (Ameisensäure) abgibt.
Damit hätte man die eine Komponente des Esters schon mal hergestellt. Jetzt muss aber auch der Alkohol Ethanol aus den vorhandenen Rohstoffen synthetisiert werden. Hier kommt dann der dritte Rohstoff, das Ethen, ins Spiel:
$C_{2}H_{4} + H_{2}O \to C_{2}H_{5}OH$
Hierbei handelt es sich um eine elektrophile Addition, in der Wasser an die C=C-Doppelbindung angelagert wird. Eine genaue Beschreibung dieses Reaktionsschrittes wird aber nicht erwartet, es müssen also keine Carbenium-Ionen etc. gezeichnet werden (schade eigentlich...).
Der letzte Reaktionsschritt ist dann die Veresterung:
$HCOOH + C_{2}H_{5}OH \to HCOO-C_{2}H_{5} + H_{2}O$
In einer Kondenstationsreaktion reagieren die Carbonsäure und der Alkohol unter Abgabe von Wasser zum Ester. Bei diesem Reaktionsschritt ist es sinnvoll, die Gleichung auch mit Strukturformeln zu zeichnen. Ein genaues Eingehen auf den Mechanismus der säurekatalysierten Veresterung wurde in den Lehrermaterialien zur Abituraufgabe aber nicht erwartet.
Aufgabe 3
Hier sollen die S. zunächst allgemein beschreiben, was typisch für eine Gleichgewichtsreaktion ist, zum Beispiel dass sie umkehrbar sind und nicht vollständig ablaufen.
Bei einer "Diskussion" sollen immer Pro-Argumente und Contra-Argumente genannt / erläutert werden, am Ende soll eine Schlussfolgerung stehen. Eine persönliche Bewertung ist bei einer "Diskussion" nicht vorgesehen.
Für den Einsatz von Schwefelsäure spricht, dass sie durch den Entzug des Reaktionsprodukts Wasser das Gleichgewicht der Veresterung nach rechts verschiebt, dadurch wird die Ausbeute an Ester gesteigert. Für die Erwähnung oder Erläuterung des Prinzip des kleinsten Zwangs sind keine Punkte vorgesehen. Eine zweite Funktion der Schwefelsäure ist die des Katalysators. Hier reicht es, wenn die S. erwähnen, dass Katalysatoren die Aktivierungsenergie einer Reaktion senken und dadurch die Reaktionsgeschwindigkeit erhöhen, so dass sich das Ester-Gleichgewicht schneller einstellt.
Gegen den Einsatz von Schwefelsäure spricht, dass sie dem Betrieb nicht zur Verfügung steht und extra dazugekauft werden muss, was erstens zusätzliche Kosten nach sich zieht und zweitens eine weitere Reinigungsstufe erforderlich macht, denn hinterher müssen die Schwefelsäure-Reste wieder entfernt werden.
Als Schlussfolgerung wird dann erwartet, dass sich der Einsatz von Schwefelsäure unter betriebswirtschaftlichen Aspekten am Ende lohnt, denn es ist wichtig, dass man in kurzer Zeit eine möglichst hohe Ausbeute an Rum-Aroma erzielt.
Im zweiten Teil der Aufgabe sollen die S. angeben, dass sich eine Destillation durchaus eignet, denn das Reaktionsprodukt (der Ester) hat auf Grund seiner unpolaren Struktur einen deutlich niedrigeren Siedepunkt als die Ausgangsstoffe Ethanol und Ameisensäure.
Fazit
Insgesamt eine sehr schöne Aufgabe, finde ich. Ich persönlich hätte starke Schwierigkeiten, selbst eine solche Aufgabe zu konstruieren. Also Hut ab vor den Kollegen, die sich die Arbeit machen, solche Aufgaben zu entwickeln!
Abitur NRW
Die Aufgaben von 2007 bis 2012 stehen online nicht mehr zur Verfügung, jedenfalls nicht mehr offiziell. Man munkelt ja, dass die alten Aufgaben irgendwann wiederverwertet werden. Ich persönlich kann mir das aber nicht vorstellen, weil sich inzwischen ja die Kernlehrpläne vollständig geändert haben. Wissen spielt ja fast so gut wie keine Rolle mehr, dafür jede Menge Kompetenzen, die in den zentralen Abituraufgaben überprüft werden sollen. Ich muss da immer an den Spruch eines Bildungsforschers denken, der gesagt hatte "Kompetenzen ohne Fachwissen ist wie Stricken ohne Wolle". Ich bin ja schon mal gespannt auf die nächsten NRW-Aufgaben für 2017, die mir leider noch nicht zur Verfügung stehen.