Der +M-Effekt
Warum verläuft die Bromierung von Phenol deutlich schneller als die Bromierung des Toluols, obwohl die OH-Gruppe doch die Elektronendichte im Benzolring wegen des -I-Effekts verringert?
Neben dem induktiven Effekt spielt in der organischen Chemie der mesomere Effekt eine große Rolle. Dazu schauen wir uns einmal die Grenzstrukturen des Phenolat-Ions näher an:
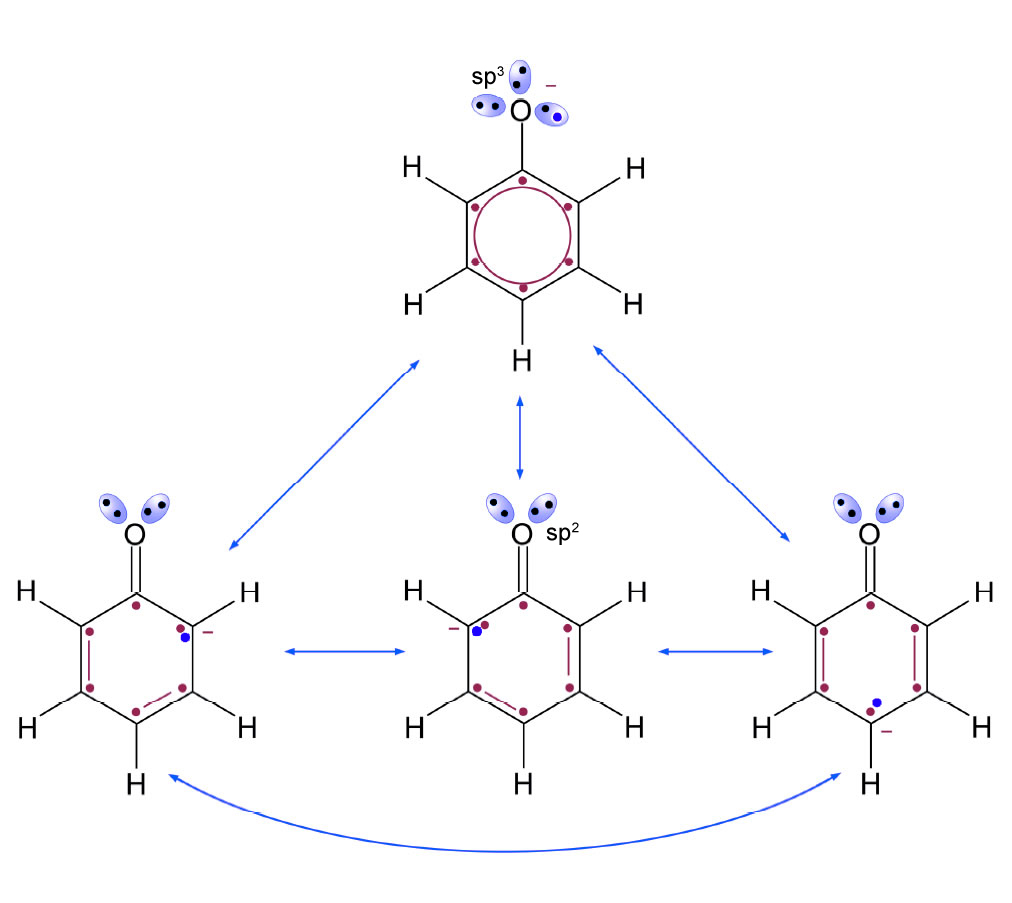
Die vier Grenzstrukturen des Phenolat-Ions
Wie man auf dieser Abbildung gut sehen kann, besitzt das Phenolat-Ion vier Grenzstrukturen. Je mehr Grenzstrukturen von einer organischen Verbindung existieren, desto stabiler (energetisch günstiger) ist das Molekül. Das Phenolat-Ion ist also sehr stabil. Das ist auch der Hauptgrund dafür, dass es sich so leicht bildet, wenn man eine Base zu einer Phenol-Lösung gibt, die das Proton der OH-Gruppe aufnehmen kann.
An sich erniedrigt die OH-Gruppe die Elektronendichte im Benzolring ja durch den negativen induktiven Effekt. Durch die Mesomerie des Phenolat-Ions jedoch wird die Elektronendichte im Ring erhöht. In der Abbildung habe ich eines der Elektronen in einem der doppelt besetzten sp3-Orbitale des O-Atoms ( = freie Elektronenpaare) blau markiert und etwas größer gezeichnet. Dieses Elektron kann nun an den Benzolring "ausgeliehen" werden und dadurch die Elektronendichte im Benzolring stark erhöhen". Dieser +M-Effekt (positiver mesomerer Effekt) erhöht die Elektronendichte im Benzolring viel stärker als der -I-Effekt der OH-Gruppe sie verringert. Der +M-Effekt kompensiert den -I-Effekt also nicht nur, sondern hat einen viel größeren Einfluss. Das erklärt also die höhere Reaktivität des Phenols/Phenolats gegenüber dem Toluol.
Aber das ist nicht die einzige Folge des +M-Effekts. Schauen Sie sich das Bild noch einmal genauer an! Die negative Ladung der drei unteren Grenzstrukturen ist auf drei bestimmte C-Atome konzentriert, nämlich auf die C-Atome 2, 4 und 6, von der OH-Gruppe aus gesehen.
Für Experten
Versuchen Sie doch selbst einmal eine Grenzstruktur zu zeichnen, in der sich die negative Ladung am C-Atom 3 aufhält. Das geht nicht.
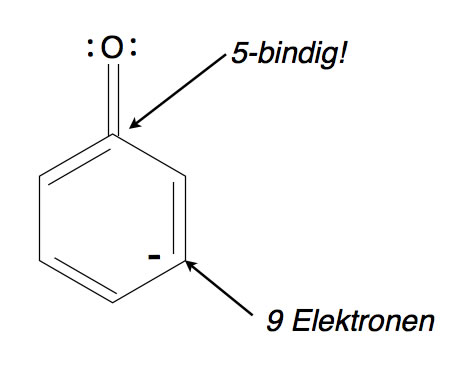
Eine solche Grenzstruktur ist unmöglich
Eine solche Grenzstruktur ist nicht möglich. Das C-Atom, das mit dem O-Atom verbunden ist, wäre dann fünfbindig, und das C-Atom 3 mit der negativen Ladung hätte neun Außenelektronen: 4 Elektronen in der Doppelbindung zu C-Atom 2, 2 Elektronen in der Einfachbindung zu C-Atom 4, 2 Elektronen in der Bindung zum H-Atom und das zusätzliche Elektron, das für die negative Ladung verantwortlich ist. Zusammen wären das neun Elektronen.
Der +M-Effekt erklärt also nicht nur die erhöhte Reaktivität des Phenol/Phenolats, sondern begründet auch, wieso die Bromierung vorrangig an den C-Atomen 2, 4 und 6 stattfindet, so dass die Hauptprodukte der Bromierung die Verbindungen 2-Brom-phenol und 4-Brom-phenol sind. Wieso gibt es kein 6-Brom-phenol? Diese Verbindung ist identisch mit 2-Brom-phenol.
Für Experten
Ich habe bisher immer von der Bromierung des Phenols/Phenolats gesprochen. Sie haben sich sicherlich schon gewundert, warum ich nie das Phenol-Molekül erwähnt/gezeichnet habe. Das möchte ich nun nachholen. Betrachten Sie bitte folgende Abbildung, die ich mal für einen alten Foliensatz von 2005 angefertigt hatte:
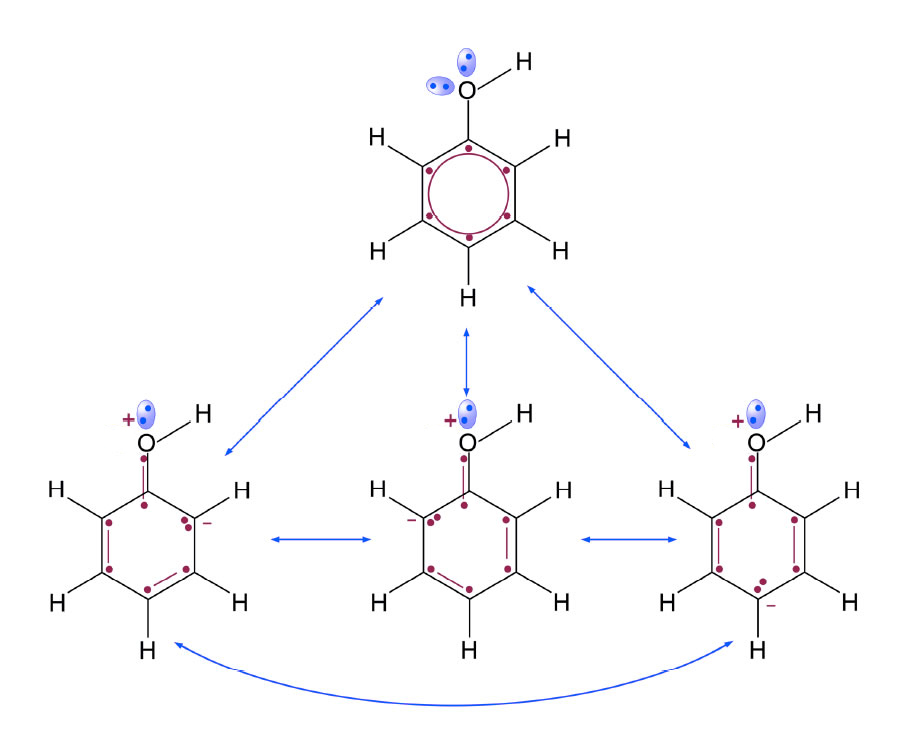
Die vier Grenzstrukturen des Phenol-Moleküls
Am O-Atom der OH-Gruppe befinden sich zwei freie Elektronenpaare. Eines dieser sp3-Elektronen beteiligt sich an dem System delokalisierter π-Elektronen. Dadurch tritt eine energetisch ungünstige Ladungstrennung auf. Dennoch dirigiert dieser Mesomerie-Effekt elektrophile Substituenten wie Brom in die 2-, 4- und 6-Position.