Wir wissen nun, dass Benzol die Summenformel C6H6 hat. Aber wie kann man die Strukturformel des Benzols bestimmen? Wenn man einmal versucht, mögliche Strukturformeln der Verbindung C6H6 aufzuzeichnen, so hat man sehr schnell zehn, zwanzig oder sogar dreißig verschiedene Strukturen zusammen. Hier nur drei Beispiele (es soll angeblich über 100 mögliche Strukturformeln geben):
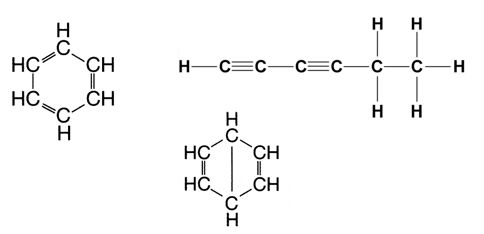
Wie kann man herausfinden, welches Strukturformel das Benzol wirklich hat? Sicherlich gibt es heute moderne Methoden wie zum Beispiel die Röntgenstrukturanalyse, mit denen man die Struktur einer Verbindung sehr gut analysieren kann. Aber wie hat man früher, im 19. Jahrhundert, als es solche Methoden noch nicht gab, die Struktur des Benzols herausgefunden? Wie ist der französische Chemiker KEKULÉ auf die berühmte Ringstruktur der Benzols gekommen?
Ermittlung einer Strukturformel mit Hilfe von Derivaten
Wir wollen uns das Grundprinzip der klassischen Vorgehensweise an einem etwas anderen Beispiel klar machen. Sie kennen die Verbindung Pentan mit der Summenformel C5H12. Wenn man n-Pentan, also das unverzweigte Isomer, mit Chlor zur Reaktion bringt, erhält man bekanntlich Chlor-pentan, Dichlor-pentan, Tricholor-pentan und so weiter. Uns interessieren hier aber nur die Monochlorierungsprodukte. Von denen gibt es genau drei Stück: 1-Chlor-pentan, 2-Chlor-pentan und 3-Chlor-pentan:
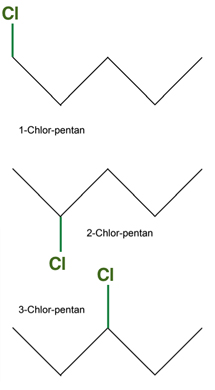
Weitere Monochlor-pentane existieren nicht, denn 4-Chlor-pentan ist ja identisch mit 2-Chlor-pentan, und 5-Chlor-pentan ist das selbe wie 1-Chlor-pentan.
Führt man jetzt den gleichen Versuch mit 2-Methyl-Butan durch, einem Isomer des n-Pentans also (gleiche Summenformel), so erhält man nicht drei, sondern vier verschiedene Monochlor-Derivate, wie die folgende Abbildung zeigt:
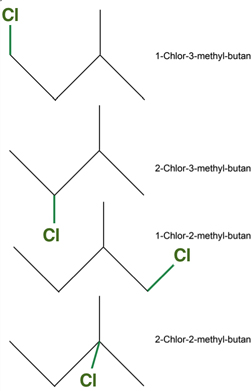
Wenn man also wissen will, ob die Verbindung mit der Summenformel C5H10 n-Pentan oder 2-Methyl-butan ist, so muss man eine Mono-Chlorierung durchführen und beispielsweise mittels Gaschromatographie die Anzahl der so erhaltenen Derivate (Abkömmlinge) ermitteln. Erhält man drei verschiedene Monochlor-pentane, so ist das Pentan unverzweigt, erhält man dagegen vier verschiedene Monochlor-pentane, so handelt es sich um das verzweigte 2-Methyl-butan.
Kommen wir zurück zum Benzol. Schon KEKULÉ schrieb im Jahre 1865:
Man muss nur… eine möglichst grosse Anzahl von Substitutionsproducten des Benzols darstellen, sie sorgfältigst in Bezug auf Isomerie vergleichen, die beobachteten Modificationen zählen, und namentlich die Ursache der Verschiedenheit aus der Art der Bildung herzuleiten suchen, und man wird sicher das Problem zu lösen im Stande sein."Anwendung des Prinzips auf Benzol
Es gibt über 100 mögliche Strukturen für Benzol. Beschränken wir uns in unseren Betrachtungen einmal auf vier mögliche Strukturformeln, damit wir heute noch fertig werden. Die folgende Abbildung zeigt die möglichen Monobromierungsprodukte:
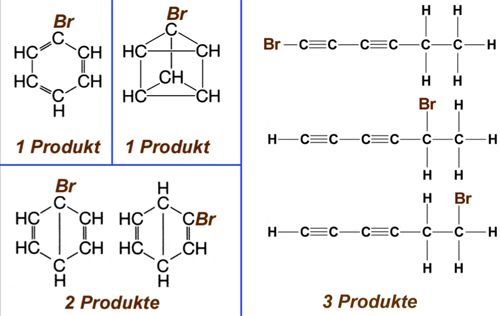
Bromiert man Benzol, kann man nur ein einziges Monobrombenzol nachweisen. Zwei der vier oben gezeigten Benzol-Strukturen scheiden damit schon einmal aus.
Geht man von 100 oder mehr möglichen Strukturformeln aus, so verbleiben natürlich 20 bis 30 Kandidaten in der Liste der möglichen Strukturen. Mit diesen Kandidaten macht man weitere Versuche, stellt zum Beispiel Dibrom-benzole her oder koppelt ein Chlor- und ein Brom-Atom an das Benzol. Auf diese Weise ist KEKULÉ zusammen mit vielen anderen Forschern schließlich zu der Ringstruktur gekommen, die noch heute gültig ist:
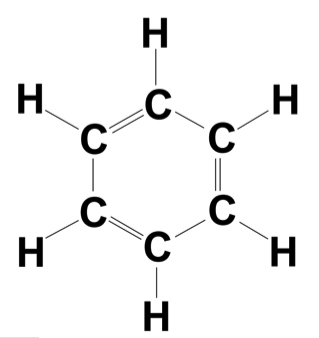
Danach besteht ein Benzol-Molekül aus sechs C-Atomen, die abwechselnd durch C-C-Einfach- und C=C-Doppelbindungen miteinander verbunden sind, sowie sechs H-Atomen. Das ganze Molekül hat eine ebene Struktur.
Ein solches Molekül habe ich einmal mit einem Molekülbaukasten zusammengebaut und photographiert:

Dass das Molekül "schief" aussieht, liegt nicht an der Qualität des Molekülbaukastens und auch nicht an der Qualität des Photos, sondern es ist in der Tat schief. Die C-C-Einfachbindungen sind deutlich länger als die C=C-Doppelbindungen, und die Bindungswinkel werden von dem Molekülmodell ebenfalls nicht korrekt wiedergegeben. In Wirklich ist die Struktur des Benzolmoleküls komplexer und gleichzeitig einfacher als hier beschrieben. Die sechs C-C-Bindungen haben alle die gleiche Länge, und die Bindungswinkel betragen einheitlich 120 Grad. Mit dem Kugelwolkenmodell kann man diese "wahre" Struktur des Benzol-Moleküls nicht erklären, hierfür benötigt man das Orbitalmodell. Wer sich dafür interessiert, schaut bitte auf den Seiten über das Orbitalmodell vorbei, die ich extra für interessierte Oberstufenschüler geschrieben habe. Wer es ganz eilig hat und das Orbitalmodell bereits kennt, kann auch gleich auf die Seite über "Das Benzol-Molekül im Orbitalmodell" gehen.
Ansonsten, wenn Sie es nicht so eilig haben, lesen Sie einfach die folgenden Seiten "Der aromatische Charakter", die ich speziell für Schüler des Chemiekurses der Stufe Q2 geschrieben habe.
Ergebnisse der Stukturformelbestimmung
Benzol hat die Strukturformel

Das Molekül besteht aus sechs C- und sechs H-Atomen. Die C-Atome sind in Form eines ebenen Ringes angeordnet und werden durch abwechselnde C-C-Einfachbindungen und C=C-Doppelbindungen zusammengehalten.