Wir haben nun die Verhältnisformel C : H = 1 : 1 für das Benzol-Molekül aufgestellt, kennen aber noch nicht die Summenformel. Mehrere Summenformeln kommen in Frage, zum Beispiel C4H4 oder auch C20H20. Welches ist nun die "echte" Summenformel, wie kann man sie bestimmen?
Bestimmung der molaren Masse
Um die Summenformel einer organischen Verbindung zu ermitteln, benötigt man weitere Informationen über diese Verbindung. Sehr hilfreich ist es, wenn man die molare Masse der Verbindung kennt. Machen wir uns das an einem Gedankenexperiment klar.
Die molare Masse einer Verbindung mit der Verhältnisformel C : H = 1 : 2 wird mit M = 120 g / mol ermittelt.
Hätte die Verbindung die Summenformel C4H8, so wäre die molare Masse = 54 g / mol, also viel zu niedrig. Versuchen wir es einmal mit C9H18. Die molare Masse wäre dann genau 126, was der ermittelten molaren Masse von 120 schon recht nahe käme. Mit der Summenformel C10H20 käme man auf eine molare Masse von 140, was schon weit über der ermittelten molaren Masse von 120 liegt.
Perfekt wären die Versuchsergebnisse nicht, aber man könnte sich recht schnell auf die Summenformel C9H18 einigen.
Wenn man die molare Masse des Benzols experimentell bestimmt, so kommt man auf einen Wert von M(Benzol) = 78,6 g / mol. Mit der Summenformel C5H5 käme man auf M(Benzol) = 65, mit der Summenformal C6H6 wäre M(Benzol) = 78, und mit der Summenformel C7H7 wäre M(Benzol) = 91 g / mol, also viel höher als der experimentell ermittelte Wert von 78,6 g / mol. Daher kommt als Summenformel für das Benzol nur C6H6 in Frage.
Verfahren zur Bestimmung der molaren Masse
Grundlage:
Ideale Gase haben unter Standardbedingungen ein molares Volumen von 22,4 L / mol. Das heißt, ein Mol eines Gases (also 6,22 * 1023 Atome bzw. Moleküle) nimmt einen Raum von 22,4 Litern ein. Das ist auf den ersten Blick verwunderlich, weil eine solche Regel für feste Stoffe oder Flüssigkeiten nicht gilt.
Durchführung:
Eine genau abgewogene Menge der Substanz wird vollständig verdampft, dann wird das Volumen des Dampfes bestimmt.
Mit der Gleichung
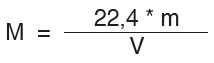
kann dann die molare Masse M des Stoffes aus der Masse m und dem Gasvolumen V bestimmt werden.
Molare Masse von Benzol:
Verdampft man m = 0,2 g Benzol, erhält man ein Volumen von V = 0,057 L. Daraus folgt für die molare Masse M = 78,6 g / mol.
Damit wäre die Summenformel C6H6 von Benzol ermittelt bzw. bestätigt.