Betrachten Sie die Strukturformeln folgender zwei Pentanole:
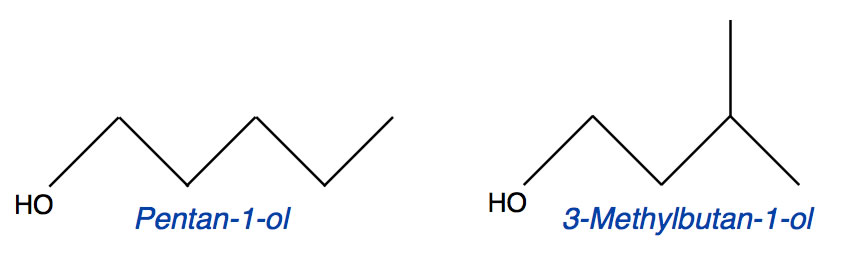
- Erklären Sie an dem Beispiel der beiden Pentanole, was man in der Chemie unter Isomerie versteht und charakterisieren Sie die hier gezeigte spezielle Art der Isomerie.
- Zeichnen und benennen Sie ALLE alkoholischen Isomere des Pentan-1-ol mit der Summenformel C5H11OH.
- Die beiden gezeigten Alkohole haben unterschiedliche Siedepunkte. Geben Sie an, welcher Alkohol den geringeren Siedepunkt hat und begründen Sie Ihre Wahl.
Lösung
1. Isomerie
Es gibt verschiedene Arten der Isomerie. Grundsätzlich unterscheidet man zwischen Konstitutions-Isomerie und Stereoisomerie. Letzteres ist hier nicht der Fall, weder ist das eine Molekül ein Spiegelbild des anderen noch handelt es sich um cis/trans-Isomerie. Bei der Konstitutions- oder Strukturisomerie unterscheidet man zwei wichtige Fälle: Bei der Skelettisomerie haben die beiden Isomere ein unterschiedliches Grundgerüst. Das ist bei diesen beiden Alkoholen nicht der Fall. Beide haben ein Pentan-Grundgerüst. Bei der Stellungs- oder Positionsisomerie liegt zwar das gleiche Grundgerüst vor, aber die funktionelle Gruppe befindet sich an einem anderen C-Atom. Genau das ist bei diesen beiden Pentanolen der Fall. Es handelt sich also um zwei Stellungs- oder Positionsisomere.
Die in der Aufgabe 2 gezeichneten acht Pentane zeigen neben der Positionsisomerie auch Skelettisomerie. Vier der Pentanole haben ein Butan-Grundgerüst, und ein Pentanol hat sogar ein Propan-Grundgerüst.
Anmerkung zum Thema "Abitur NRW"
Eine vergleichbare Teilaufgabe wurde 2015 in der Grundkurs-Aufgabe "Isomere Pentanole" gestellt. Hier die von den Schülern erwartete Leistung: "Die beiden Pentanole besitzen dieselbe Summenformel, aber unterschiedliche Strukturformeln". Dafür gab es dann aber auch nur 2 Punkte.
2. Die verschiedenen Pentanole
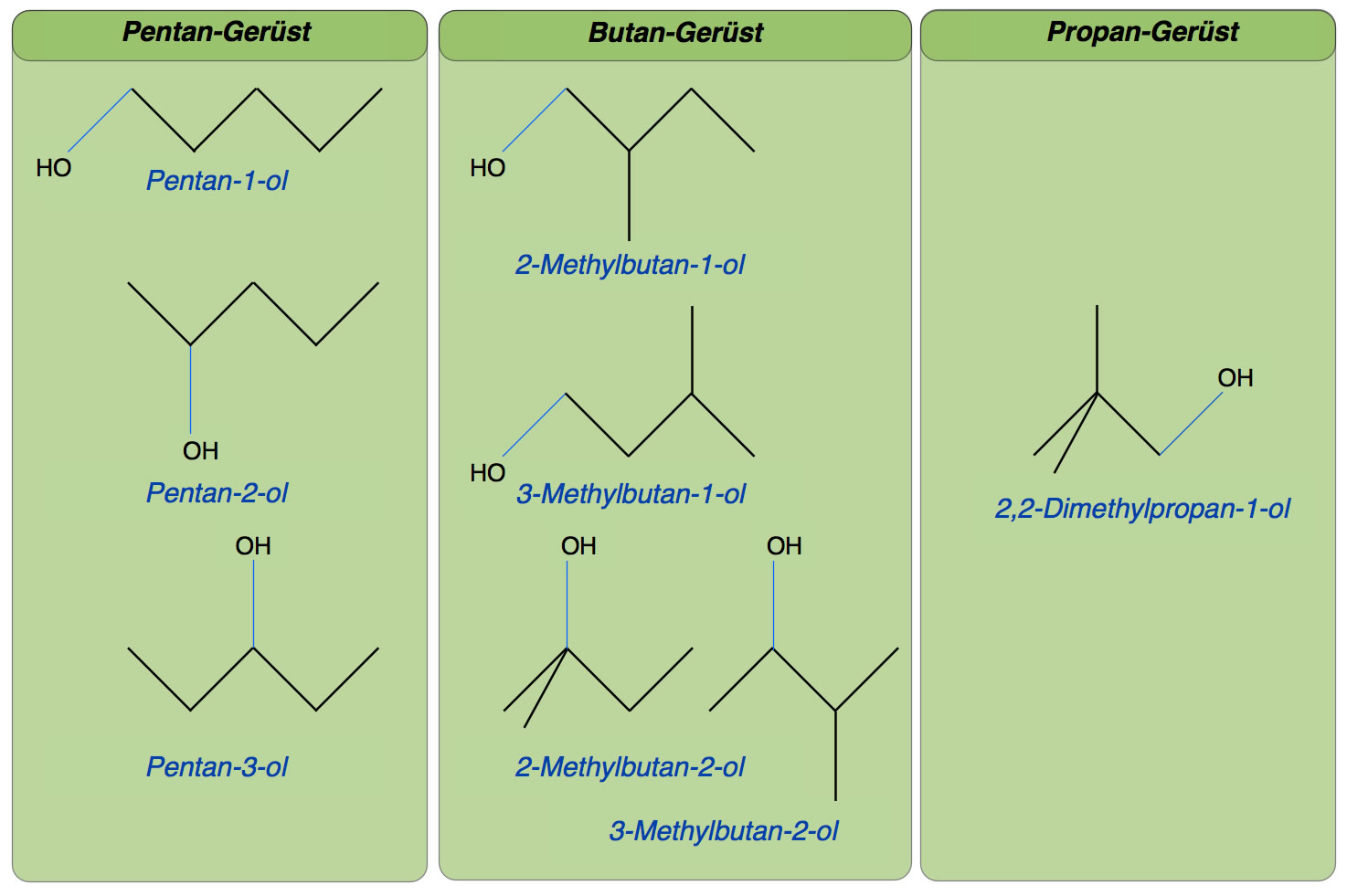
Einzelheiten zu diesen Pentanolen finden Sie auf der übersichtlichen Wikipedia-Seite "Pentanole".
4. Siedepunkte
Der Siedepunkt einer organischen Verbindung hängt stark von den van-der-Waals-Kräften ab, die zwischen den Molekülen der Verbindung herrschen. Sind funktionelle Gruppen mit elektronegativen Atomen vorhanden, können die Anziehungskräfte zwischen den Molekülen auch durch Dipol-Dipol-Wechselwirkungen verstärkt werden. Besitzen die Moleküle Atomgruppen, die Wasserstoffbrücken-Bindungen untereinander herstellen können, sind die Anziehungskräfte und damit die Siedepunkte besonders hoch.
Die beiden gezeigten Pentane verfügen über OH-Gruppen, die miteinander H-Brücken bilden können. Daher haben Alkohole grundsätzlich recht hohe Siedepunkte.
Das 3-Methyl-butan-1-ol-Molekül ist aber etwas kompakter gebaut als das Pentan-1-ol-Molekül, daher sollten die van-der-Waals-Kräfte, die ja von der Kontaktfläche zwischen den Molekülen abhängen, hier etwas geringer sein. Das 3-Methyl-butan-1-ol sollte also den geringeren Siedepunkt haben.
Anmerkung (gehört nicht zur Lösung)
In der Tag hat 3-Methyl-butan-1-ol einen Siedepunkt von 131 ºC, während Pentan-1-ol einen Siedepunkt von 138 ºC hat. Der Unterschied ist also nicht groß. Das liegt einmal daran, dass das 3-Methyl-butan-1-ol-Molekül ebenfalls noch recht langgestreckt ist, und vor allem daran, dass der Siedepunkt hauptsächlich durch die H-Brücken zwischen den OH-Gruppen bestimmt wird.
Den niedrigsten Siedepunkt hat übrigens das 2-Methyl-butan-2-ol (102 ºC) und nicht wie vielleicht erwartet das 2,2-Dimethyl-propan-1-ol (113 ºC). Aber wenn man sich die Strukturen so richtig ansieht, hat die erstgenannte Verbindung tatsächlich eher eine kugelförmige Gestalt als die zweitgenannte.