Physikalische Eigenschaften der Alkohole
Zu diesem Thema gibt es eine neuere Seite vom Dezember 2024, die ich extra für Schüler(innen) der Stufe EF geschrieben habe.
Hier geht es zur neuen Seite für die Stufe EF.
Vergleicht man die Siedetemperaturen von Alkanolen (das sind Alkohole mit einem Alkan-Grundgerüst) mit denen der entsprechenden Alkane, so stellt man fest, dass die Alkohole bei viel höheren Temperaturen sieden. Zum Beispiel siedet n-Hexan bei 69 ºC, während Hexan-1-ol eine Siedetemperatur von 157 ºC hat.
Die folgende Tabelle zeigt die Siedetemperatur der ersten zehn Alkanole:
| Alkohol | Siedetemperatur |
|---|---|
| Methanol | 64,7 |
| Ethanol | 78,3 |
| Propan-1-ol | 97,2 |
| Butan-1-ol | 117,3 |
| Pentan-1-ol | 138,0 |
| Hexan-1-ol | 157,5 |
| Heptan-1-ol | 176,0 |
| Octan-1-ol | 194,5 |
| Nonan-1-ol | 215,0 |
| Decan-1-ol | 228,0 |
Im folgenden Bild sehen wir eine graphische Darstellung dieser Siedepunkte:
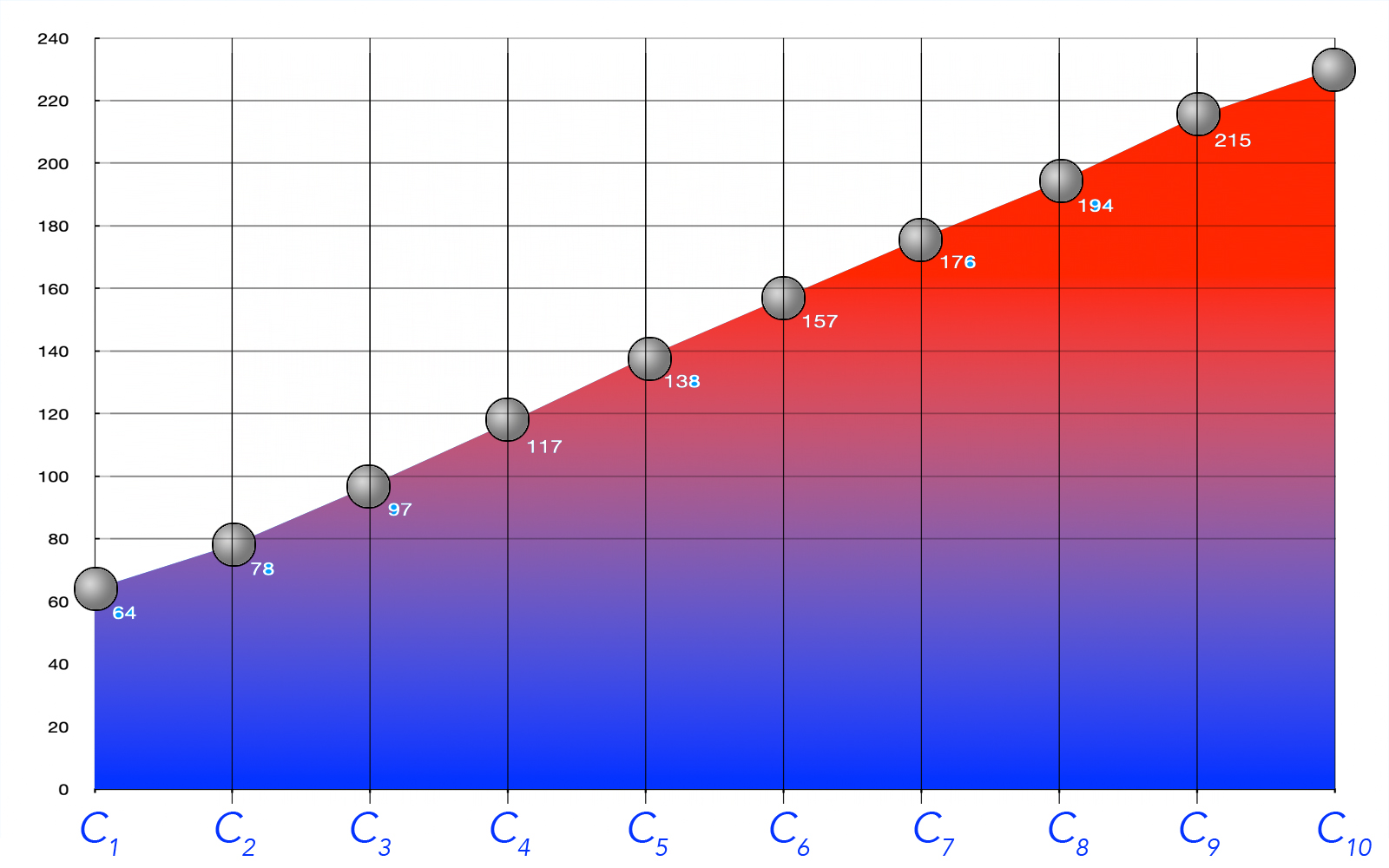
Siedepunkte der ersten 10 Alkanole
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei der Betrachtung der Ursachen dieser Siedetemperatur müssen wir mehrere Faktoren unterscheiden.
Faktor 1: H-Brücken
Die Hydroxygruppe (OH-Gruppe) ist dafür verantwortlich, dass die Siedetemperaturen der Alkanole allgemein höher liegen als die Siedetemperaturen der Alkane mit gleicher Kohlenstoffzahl. Zwischen den OH-Gruppen von zwei Alkohol-Molekülen können sich nämlich H-Brücken bilden, und genau das treibt den Siedepunkt ziemlich weit nach oben.
Beispiel:
Der Siedepunkt von Hexan-1-ol ist um 88 ºC höher als der Siedepunkt von Hexan.
Alles zum Thema H-Brücken finden Sie auf dieser Lexikon-Seite. Wahrscheinlich mehr, als Sie verkraften können!
Faktor 2: van-der-Waals-Kräfte
Die relativ hohen Siedetemperaturen der Alkanole im Vergleich zu Alkanen, Aldehyden oder anderen Stoffklassen kann man mit dem ersten Faktor (H-Brücken) gut erklären. Warum aber steigen die Siedetemperaturen innerhalb der homologen Reihe der Alkanole an? Jedes Molekül dieser homologen Reihe hat doch nur eine einzige OH-Gruppe.
Müssten dann die Siedepunkte mit steigender C-Anzahl nicht sogar abnehmen ? Mit zunehmender Kettenlänge gewinnt der Alkohol ja dann immer stärkeren Alkan-Charakter, und Alkane haben doch bekanntlich geringere Siedepunkte als Alkohole.
Diese Vermutung ist leider falsch! Was man immer leicht vergisst, wenn man sich mit Alkoholen beschäftigt, sind die van-der-Waals-Kräfte zwischen den Kohlenstoffketten der Alkohol-Moleküle. Diese schwachen chemischen Anziehungskräfte ignoriert man oft, sie sind aber die Ursache dafür, dass die Siedepunkte der Alkohole mit zunehmender Kettenlänge ansteigen.
Alles zu diesem Thema finden Sie auf dieser Lexikonseite, die weit über das EF-Niveau hinausgeht. Aber Sie müssen ja nicht alles lesen und verstehen...
Kommen wir nun zu zwei weiteren Faktoren, welche die Siedetemperatur eines Alkanols beeinflussen.
Faktor 3: Stellung der OH-Gruppe im Alkanol
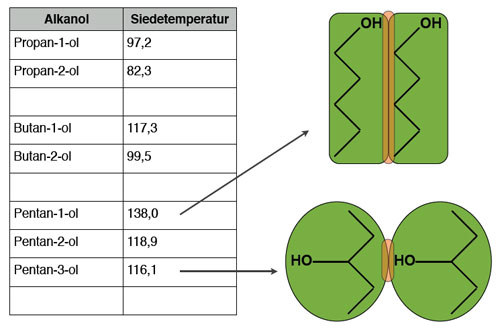
Abhängigkeit der Siedetemperatur von der Struktur des Alkohol-Moleküls
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Auf diesem Bild sehen wir, welchen Einfluss die Stellung der OH-Gruppe auf den Siedepunkt eines Alkohols hat; besonders gut ist das bei den drei Pentanolen erkennbar. Die Zeichnung rechts neben der Tabelle liefert die Erklärung dafür. Oben sehen wir zwei Pentan-1-ol-Moleküle, unten zwei Pentan-3-ol-Moleküle, stark schematisiert. Die Kontaktflächen - und damit die van-der-Waals-Kräfte - sind bei den langgestreckten Molekülen wesentlich größer als bei den eher kugelförmigen Molekülen. Das erklärt die niedrigen Siedetemperaturen der sekundären Alkohole Propan-2-ol, Butan-2-ol und Pentan-2-ol bzw. Pentan-3-ol gegenüber den primären Alkoholen.
Faktor 4: Zahl der OH-Gruppen
Schauen wir uns nun die folgende Tabelle an. Sie verdeutlicht den vierten Faktor, der die Siedetemperatur eines Alkanols bestimmt.
| Alkohol | Siedetemperatur |
|---|---|
| Methanol | 64,7 |
| Ethanol | 78,3 |
| Ethan-1,2-diol | 197,2 |
| Propan-1-ol | 97,2 |
| Propan-1,2-diol | 188,0 |
| Propan-1,3-diol | 215,0 |
| Propan-1,2,3-triol | 290 |
Die Zahl der OH-Gruppen spielt eine entscheidende Rolle! Je mehr OH-Gruppen, desto höher der Siedepunkt. Die Ursache hierfür sind wieder einmal die Wasserstoffbrückenbindungen, die zwischen den OH-Gruppen der Moleküle bestehen. Je mehr OH-Gruppen, desto mehr H-Brücken können sich zwischen den Molekülen bilden, und desto höher der Siedepunkt!
Beispiel Hexanol und Glucose
Beide Moleküle besitzen sechs C-Atome, Hexan-1-ol hat aber nur eine OH-Gruppe, Glucose deren sechs. Der Siedepunkt von Hexan-1-ol liegt bei 157,5 ºC, Glucose (Traubenzucker) hat keinen Siedepunkt, weil sich die Verbindung vorher schon chemisch zersetzt. Bei 145 ºC ist wasserfreie Glucose immer noch fest, sie schmilzt bei 146 ºC. Hexan-1-ol ist bei dieser Temperatur schon kurz vor dem Sieden.
Merke:
Siedetemperaturen der Alkanole
Der Siedepunkt eines Alkohols hängt von vier Faktoren ab:
- Vorhandensein der OH-Gruppen: Generell haben Alkanole einen deutlich höheren Siedepunkt als die entsprechenden Alkane. Ursache hierfür sind die H-Brücken zwischen den Alkanol-Molekülen.
- Länge des Alkylrestes: Je länger der Alkylrest, desto stärker die van-der-Waals-Kräfte zwischen den Molekülen und desto höher die Siedetemperatur.
- Stellung der OH-Gruppe(n) im Molekül: Je langgestreckter das Molekül, desto größer die van-der-Waals-Kontaktfläche und desto höher der Siedepunkt; je "kugelförmiger" des Molekül, desto niedriger der Siedepunkt.
- Anzahl der OH-Gruppen: Je mehr OH-Gruppen im Molekül, desto höher der Siedepunkt.
Ergänzung 2025
Die Zeichnung zu den Siedepunkten der Pentanole Pentan-1-ol und Pentan-3-ol, die ich 2017 angefertigt hatte, gefällt mir nicht mehr so richtig gut. Sie enthält einen ziemlich gravierenden sachlichen Fehler: Die Neigung der Moleküle, H-Brücken zu bilden, wird überhaupt nicht berücksichtigt. Zwei Pentan-3-ol-Moleküle würden sich niemals so anordnen, wie auf dem ursprünglichen Bild zu sehen ist:

So würden sich zwei Pentan-3-ol-Moleküle wahrscheinlich nicht anordnen
Autor: Ulrich Helmich 1/2025, Lizenz: Public domain
Dieses Bild zeigt eine eher unwahrscheinliche Anordnung von zwei Pentan-3-ol-Molekülen.

Eine verbesserte Darstellung der intermolekularen Kräfte zwischen Pentanol-Molekülen
Autor: Ulrich Helmich 1/2025, Lizenz: Public domain
Hier sehen Sie eine verbesserte Darstellung der Anordnung von zwei Pentan-1-ol und zwei Pentan-3-ol-Molekülen. Diese Graphik habe ich im Januar 2025 neu erstellt (obwohl ich wegen einer Augen-OP kaum was sehen konnte).
Die roten Doppelpfeile deuten die starken H-Brücken an, die sich zwischen den OH-Gruppen der beiden Moleküle bilden, die beigen Doppelpfeile sollen die London-Kräfte verdeutlichen, die zwischen den C-Ketten der Moleküle herrschen.
Die beiden Pentan-1-ol-Molekülen können sich so anordnen, dass eine große Kontaktfläche entsteht, so dass starke London-Kräfte herrschen, welche die H-Brücke zwischen den Molekülen unterstützen.
Da H-Brücken stärker und damit energetisch günstiger sind als London-Kräfte, ordnen sich die beiden Pentan-3-ol-Moleküle höchstwahrscheinlich so an, wie im Bild rechts gezeigt, damit sie eine H-Brücke bilden können. Dadurch rücken die Kohlenstoff-Ketten der Pentanole jedoch weiter auseinander als bei Pentan-1-ol. Die London-Kräfte sind also deutlich schwächer als bei den Pentan-1-ol-Molekülen, und damit ist auch die Gesamtstärke der intermolekularen Anziehungskraft geringer. Die Folge ist ein niedrigerer Siedepunkt.