Die O-H-Bindung ist polarer als eine C-H-Bindung
Auf dieser Seite wollen wir herausfinden, wieso die Hydroxygruppe den Alkoholen ihre besonderen physikalischen Eigenschaften verleiht. Betrachten wir dazu eine Tabelle mit den Elektronegativitäten der Hauptgruppenelemente:
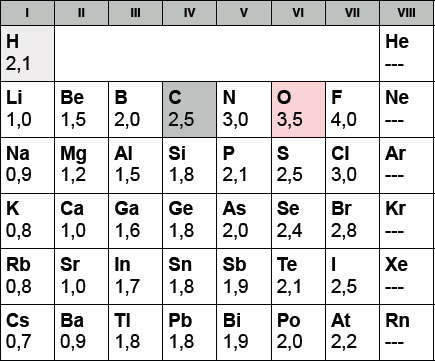
Die Polarität einer kovalenten Bindung hängt davon ab, wie unterschiedlich die Elektronegativitäten der beiden verbundenen Atome sind.
Bei der Kohlenstoff-Wasserstoff-Bindung beträgt die EN-Differenz nur 0,4. Das ist nicht sehr viel, daher wird die C-H-Bindung meistens als "unpolar" bezeichnet, was ja aber nicht so ganz stimmt. Das C-Atom ist bei der C-H-Bindung leicht negativ geladen, das H-Atom leicht positiv. Auf die physikalischen Eigenschaften eines Kohlenwasserstoffs wirkt sich diese leichte Polarität aber so gut wie nicht aus.
Bei der Sauerstoff-Wasserstoff-Bindung sieht die Sache schon anders aus. Hier beträgt die EN-Differenz 1,4. Das ist ein sehr hoher Wert. Die O-H-Bindung ist daher recht polar. Das O-Atom trägt eine starke negative Teilladung, das H-Atom eine starke positive Teilladung. Diese Teilladung ist aber nicht zu verwechseln mit einer "richtigen" Ladung, wie sie beispielsweise beim positiv geladenen Proton oder beim negativ geladenen Bromid-Ion auftritt. Eine "richtige" Ladung ist wesentlich stärker als die Teilladungen der Atome der Hydroxygruppe.