Von Ulrich Helmich, Stand: 22.10.2022
Eine Zuckerstange in Wasser
Stellen wir Gedanken eine Stange Zucker in ein Glas mit Wasser. Was wird geschehen? Im Laufe der Zeit wird sich ein Teil der Zuckerstange auflösen; es entsteht schließlich eine gesättigte Lösung von Zuckerwasser.
Triebkraft für das Auflösen des Zuckers ist einmal die Entropiezunahme, die damit verbunden ist, und zum andern die Hydratisierung der hydrophilen Zucker-Moleküle, bei der etwas Energie freigesetzt wird.
Irgendwann ist die wässrige Zuckerlösung aber so gesättigt, dass sich keine weiteren Zucker-Moleküle mehr lösen können. Es ist ein Lösungsgleichgewicht erreicht. Dieses Lösungsgleichgewicht ist ein dynamisches Gleichgewicht. In einer bestimmten Zeiteinheit lösen sich genau so viele Zucker-Moleküle im Wasser, wie auch wieder in den festen Zustand übergehen (Geschwindigkeit der Hinreaktion = Geschwindigkeit der Rückreaktion).
Ein außenstehender Beobachter, der in Besitz eines (noch nicht existierenden) Ultra-Mikroskops ist, würde dann zum Beispiel beobachten können, dass in einer Millisekunde pro Quadratmikrometer der Zuckerstange x Zuckermoleküle in Lösung gehen; während sich in der gleichen Zeit x bereits gelöste und hydratisierte Zuckermoleküle wieder als Feststoff an der Stange abscheiden.
$Zucker(s) \rightleftharpoons Zucker(aq)$
Eine Zinkstange in Wasser
Wenn man eine Zinkstange in ein Glas mit Wasser stellt, sollte im Prinzip der gleiche Vorgang ablaufen: Ein Teil des Zinks sollte sich im Wasser auflösen, bis eine gesättigte Lösung entstanden ist. Dann sollte es wieder zu dem eben beschriebenen dynamischen Gleichgewicht kommen, dem Lösungsgleichgewicht. Allerdings wissen wir aus dem Alltag, dass sich die meisten Metalle so gut wie nicht im Wasser auflösen. Wie kommt das?
Betrachten wir dazu die folgende Abbildung:
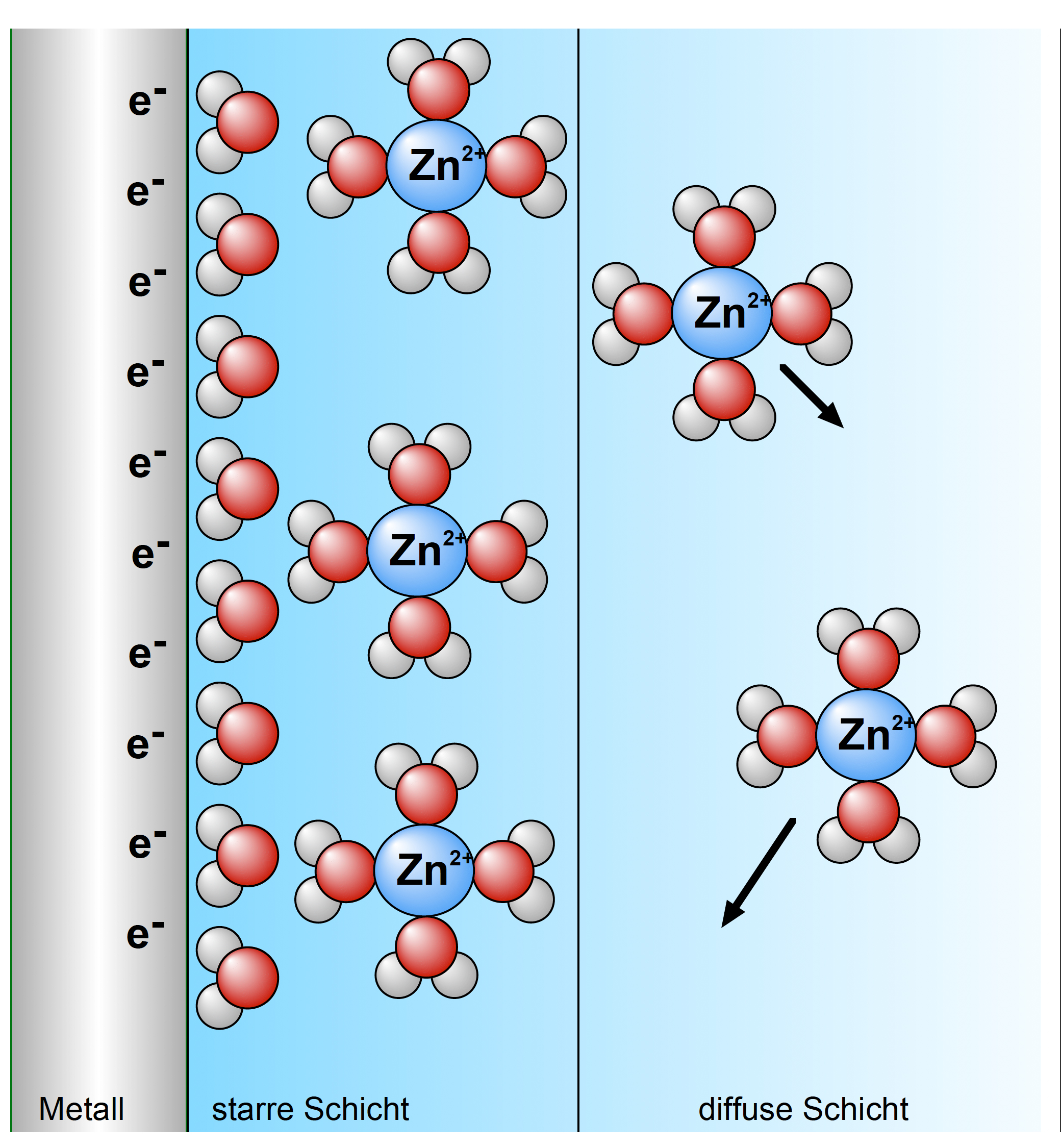
Die elektrochemische Doppelsicht an der Metall-Elektrode
Autor: Ulrich Helmich 2007, Lizenz: Public domain.
Links sehen wir die Zinkstange. Fünf Zink-Atome haben sich im Wasser gelöst, allerdings nicht in Form von atomarem Zink, sondern in Form positiv geladener Zink-Ionen, die hydratisiert sind:
$Zn(s) \rightleftharpoons Zn^{2+}(aq)+ 2 \ e^{-}$
Die von den Zn-Atomen abgegebenen Außenelektronen verbleiben in der Zinkstange. Dadurch lädt sich diese negativ auf. Mit jedem abgegebenem Zn2+-Ion steigt die negative Ladung der Zinkelektrode um zwei Einheiten.
Je stärker die Zinkstange aber negativ geladen ist, desto stärker zieht sie die bereits gelösten Zinkionen an. Irgendwann ist die Zinkstange so negativ aufgeladen, dass sie pro Zeiteinheit genau so viele Zink-Ionen anzieht, wie sich Zink-Ionen von ihr lösen. Es herrscht dann ein dynamisches Gleichgewicht, das sogenannte elektrochemische Gleichgewicht.
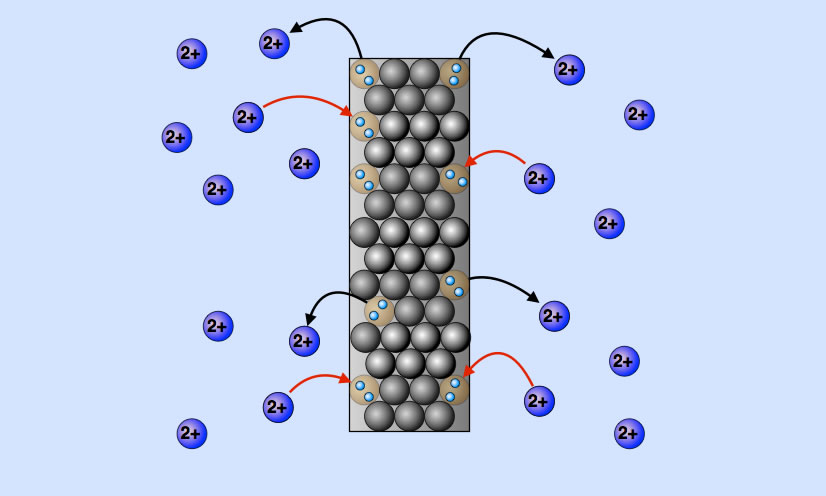
Elektrochemisches Gleichgewicht in einer Zink-Elektrode
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Hier sieht man eine Zink-Elektrode, aus der sich gerade vier Zink-Ionen gelöst haben. Innerhalb der gleichen Zeiteinheit werden jedoch vier andere Zink-Ionen von der Zink-Elektrode wieder angezogen.
Ein galvanisches Element
Aufbau der Spannung
Wie erklärt sich nun die Spannung, die man in der "Wasserbatterie" messen kann?
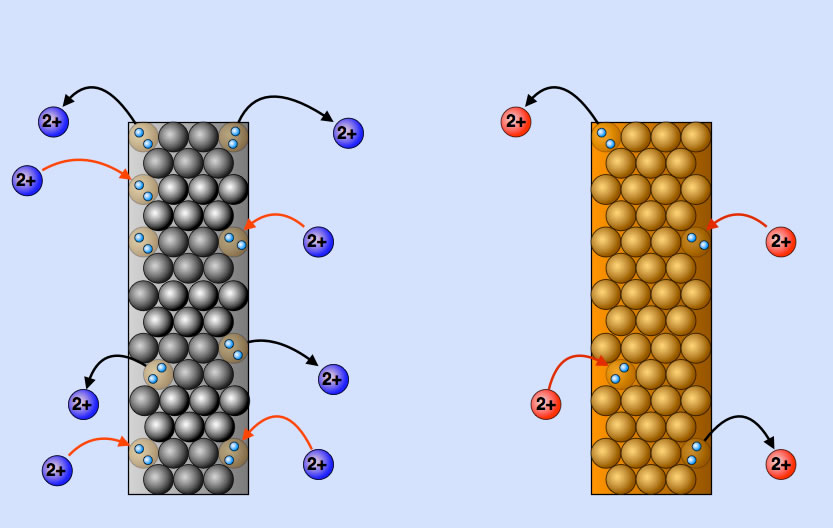
Elektrochemische Gleichgewichte in Zink- und Kupfer-Elektroden
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Links sehen wir eine Zink-Elektrode im elektrochemischen Gleichgewicht. Vier Zink-Ionen haben sich gerade gelöst, und vier andere Zink-Ionen werden wieder angezogen.
Rechts sehen wir eine Kupfer-Elektrode, die sich ebenfalls im elektrochemischen Gleichgewicht befindet. Allerdings ist Kupfer ein Edelmetall. Die Neigung der Cu-Atome, zwei Elektronen abzugeben, ist nicht so groß wie bei den Zn-Atomen. Daher haben sich in der betrachteten Zeiteinheit nur zwei Cu-Atome in Form von Cu2+-Ionen gelöst, und es werden nur zwei Cu2+-Ionen wieder angezogen.
Was passiert nun, wenn man die beiden Metalle elektrisch leitend miteinander verbindet?
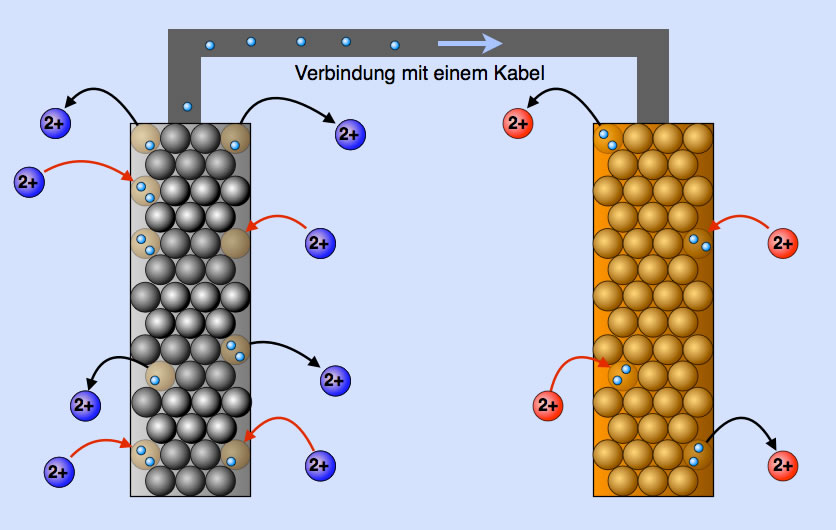
Elektronenfluss vom Zink zum Kupfer
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Betrachten wie die beiden Metalle näher. In der Zinkstange befinden sich viele Elektronen, da sich viele Zink-Atome in Form von Zink-Ionen gelöst haben. In der Kupferstange befinden sich nur wenige Elektronen, denn es haben sich ja auch nur wenige Kupfer-Atome gelöst.
Es herrscht also ein Ladungsunterschied. Die negative Ladung im Zink ist größer als die im Kupfer. Verbinden wir nun die beiden Elektroden mit einem Kabel, so wandern Elektronen von dem Ort mit der höheren Ladungsdichte (Zink) zum Ort mit der geringeren Ladungsdichte (Kupfer), weil ein Ladungsausgleich angestrebt wird.
Damit haben wir die erste wichtige Frage schon geklärt: Wie kommt die messbare Spannung von ca. 0,8 V zustande, die wir in der Wasserbatterie messen können.
Bei der Wasserbatterie messen wir eine Spannung zwischen der Zink- und der Kupfer-Elektrode, weil sich das Zink schneller als Zn2+(aq) im Wasser auflöst als das Kupfer als Cu2+(aq). Daher ist die Elektronendichte im Zink höher als im Kupfer, und dieser Ladungsunterschied kann als Spannung gemessen werden.
Aufrechterhaltung der Spannung
Kommen wir nun zu einer zweiten Frage, die sich stellt, wenn man mal etwas länger nachdenkt:
Warum fällt die Spannung nicht ab, sobald der Ladungsausgleich erreicht ist?
Das ist eine gute Frage. Um diese Frage zu beantworten, muss man sich wieder ins Gedächtnis rufen, was man eigentlich unter einem chemischen Gleichgewicht versteht. Betrachten wir noch einmal die Reaktion an der Zink-Elektrode:
$Zn_{(s)} \rightleftharpoons Zn^{2+}_{(aq)}+ 2 \ e^{-}$
An der Zink-Elektrode bewirkt das Prinzip des kleinsten Zwangs, dass sich das Gleichgewicht nach rechts verschiebt, wenn die Elektronen zum Kupfer wandern. Die "Konzentration" der Elektronen wird durch das Abwandern ja kleiner. Es löst sich also weiteres Zink im Wasser, und dadurch entstehen wieder neue Elektronen im Zink. Die Ladungsdichte im Zink steigt wieder an, der Ladungsunterschied wird wieder größer, und weitere Elektronen fließen zwecks Ladungsausgleich zum Kupfer.
Schauen wir uns nun die Vorgänge an der Kupfer-Elektrode an:
$Cu_{(s)} \rightleftharpoons Cu^{2+}_{(aq)}+ 2 \ e^{-}$
Die Elektronen, die zwecks Ladungsausgleich vom Zinkblech kommen, verschieben das Gleichgewicht der Reaktion noch weiter nach links. Bereits gelöste Kupfer-Ionen nehmen also zwei Elektronen auf und setzen sich wieder am Kupferblech ab.
Dies setzt allerdings voraus, dass noch weitere Kupfer-Ionen in der Lösung vorhanden sind. Ist das nicht der Fall, wird die Spannung zwischen den beiden Elektroden tatsächlich mit der Zeit immer weniger.
Damit wären wir eigentlich schon beim nächsten größeren Abschnitt, dem DANIELL-Element.
Für interessierte Schüler (und Kollegen) habe ich noch eine kurze Seite über die Rolle der Oxonium-Ionen bei der Zitronenbatterie geschrieben.
Seitenanfang -
Zwei Versuche -
Wasserbatterie -
Zitronenbatterie -
DANIELL-Element -
Galvanische Zellen