Definitionen
Nach BRÖNSTED sind Säuren Protonendonatoren und Basen Protonenakzeptoren. Hier noch einmal die wichtigsten Definitionen, die für das Chemie-Abitur hilfreich sein könnten:
Protonendonator
Unter einem Protonendonator oder einer Säure versteht man ein Ion oder Molekül, das ein H-Atom besitzt, welches an ein elektronegatives Atom gebunden ist und daher leicht heterolytisch gespalten werden kann. Bei dieser Heterolyse wird das Proton abgegeben, und zurück bleibt der sogenannte Säurerest.
Protonenakzeptor
Unter einem Protonenakzeptor oder einer Base versteht man ein Atom, Ion oder Molekül mit einem elektronegativen Atom, das ein freies Elektronenpaar besitzt, an das sich ein Proton anlagern kann.
Protolyse
Eine Protolyse ist eine chemische Reaktion, bei der ein Proton von einem Protonendonator (einer Säure) auf einen Protonenakzeptor (eine Base) übertragen wird.
Erläuterungen
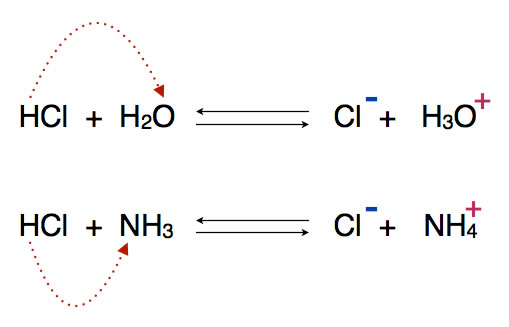
Oben im Bild ist zu sehen, wie ein Salzsäure-Molekül ein Proton an ein Wasser-Molekül abgibt. HCl ist hier der Protonendonator, H2O der Protonenakzeptor.
Unten im Bild kann man sehen, wie ein HCl-Molekül ein Proton an ein Ammoniak-Molekül abgibt. HCl ist hier wieder der Protonendonator, NH3 der Protonenakzeptor. Wasser ist an dieser Protolyse nicht beteiligt! Das kommt nämlich auch vor in der Chemie - Protolysen ohne Beteiligung von Wasser.
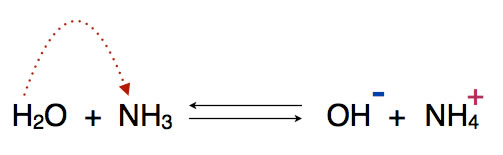
Hier eine Protolyse, bei der Wasser als Protonendonator auftritt und Ammoniak als Protonenakzeptor.
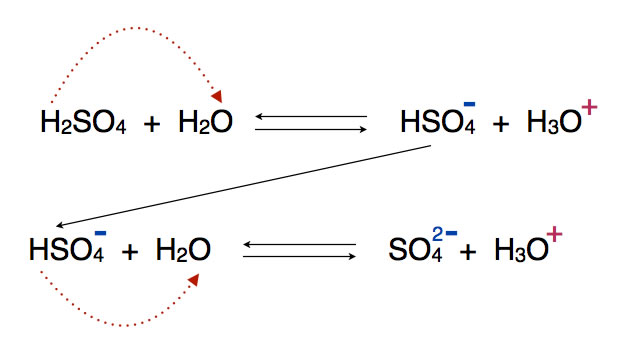
Und am Ende noch die Protolyse der zweiprotonigen Schwefelsäure, die in zwei Schritten erfolgt. Wasser tritt bei beiden Schritten als Base auf, als Protonenakzeptor also.
Phosphorsäure H3PO4 ist sogar eine dreiprotonige Säure, also gibt es hier drei Protolysestufen.
Säure und saure Lösung
Eine Säure ist nach BRÖNSTED ein Teilchen, das in der Lage ist, H-Atome als Protonen abzugeben. Eine saure Lösung dagegen ist eine wässrige Lösung, welche Säure-Moleküle enthält, die Protonen an Wasser-Moleküle abgegeben haben, so dass sich Oxonium-Ionen gebildet haben.
saure Lösung
Eine saure Lösung ist eine wässrige Lösung, deren Oxoniumionen-Konzentration deutlich größer ist als 10-7 mol/l. Verursacht wird die hohe Oxoniumionen-Konzentration durch eine im Wasser gelöste Säure, welche Protonen an Wasser-Moleküle abgegeben hat.
Salzsäure ist beispielsweise keine Säure, sondern eine saure Lösung, die dissoziierte Chlorwasserstoff-Moleküle enthält. Chlorwasserstoff ist dagegen eine Säure, denn HCl-Moleküle können Protonen zum Beispiel an Wasser-Moleküle oder Ammoniak-Moleküle abgeben. Haushaltsessig ist eine Lösung von Essigsäure in Wasser, also eine saure Lösung. Allerdings sind hier nicht alle Essigsäure-Moleküle dissoziiert, sondern nur ein kleiner Teil. Trotzdem spricht man hier von einer sauren Lösung.
Abitur NRW
In fast allen Abituraufgaben, die irgendwas mit Säuren oder Basen zu tun haben, wird von den Schülern verlangt, dass sie das BRÖNSTEDsche Säure-Base-Konzept auf die Reaktionen anwenden, um die es in der jeweiligen Aufgabe gerade geht. Sie müssen sich also die Reaktionsgleichungen der Protolysen gut anschauen und dann die jeweiligen Protonendonatoren und -akzeptoren identifizieren. Besonders interessant ist das natürlich bei zwei- oder dreiprotonigen Säuren; hier müssen Sie zwei bzw. drei Protolyseschritte analysieren und die Edukte und Produkte korrekt benennen. Üben Sie das möglichst oft!