Einfache Erklärung der Ergebnisse
Bevor wir wieder hochtheoretische Überlegungen anstellen, die nur angehende Professoren verstehen, wollen wir die Versuchsergebnisse erst mal recht einfach erklären, quasi auf Sekundarstufe I - Niveau.
Beobachtungen:
- Während der HCl-Einleitung ändert sich die Farbe des Indikators von grün über gelb und orange nach rot,
- Die elektrische Leitfähigkeit nimmt während des Versuchs deutlich zu.
- Vor dem Versuch fiel die Silbernitrat-Probe negativ aus, nach dem Versuch kann man eine deutliche Trübung erkennen.
Beobachtung 1
Die HCl-Moleküle spalten sich heterolytisch in positiv geladene Protonen und negativ geladene Chlorid-Ionen:
$HCl_{(aq)} \to H^{+}_{(aq)} + Cl^{-}_{(aq)}$
Die Protonen sorgen für die Rotfärbung des Indikators.
Beobachtung 2
Protonen und Chlorid-Ionen sind elektrische Ladungsträger. Werden sie durch die Spaltung der HCl-Moleküle freigesetzt, steigt die elektrische Leitfähigkeit der Lösung an.
Beobachtung 3
Die Trübung der Lösung nach Zugabe von Silbernitrat ist auf die entstandenen Chlorid-Ionen zurückzuführen: Es bildet sich schwer lösliches Silberchlorid.
Die Reaktion von HCl mit Wasser ist exotherm
Nach dieser einfachen Deutung wollen wir uns die Reaktion mal etwas näher anschauen, wie es sich für den Unterricht in der gymnasialen Oberstufe auch gehört.
Die Beobachtung 1 hatten wir so gedeutet, dass die HCl-Moleküle heterolytisch in Protonen und Chlorid-Ionen zerfallen. Ganz so einfach ist das aber nicht. Wenn wir den gasförmigen Chlorwasserstoff nicht auf die Wasseroberfläche geleitet hätten, wären die HCl-Moleküle nicht zerfallen, höchstens ganz wenige.
Für die heterolytische Spaltung eines HCl-Moleküls ist nämlich ein Energieaufwand von 431 kJ/mol erforderlich (Bindungsdissoziationsenergie), was für eine spontane heterolytische HCl-Spaltung viel zu hoch ist. Nur ein ganz geringer Bruchteil der HCl-Moleküle zerfällt bei Zimmertemperatur spontan in Protonen und Chlorid-Ionen.
Für Experten
"Zimmertemperatur" hört sich nicht besonders hoch an. Man bedenke aber, dass der absolute Nullpunkt bei -273 ºC liegt. Die Zimmertemperatur ist somit ca. 293 ºC höher als der absolute Nullpunkt. Die HCl-Moleküle bewegen sich daher schon mit ziemlicher Geschwindigkeit und auch innerhalb der HCl-Moleküle finden Schwingungen statt. Bei der im Vergleich zum absoluten Nullpunkt doch recht hohen Temperatur von +20 ºC können diese Schwingungen im Ausnahmefall so stark sein, dass eine spontane Dissoziation der HCl-Moleküle stattfindet. Aber wie bereits gesagt, bei Zimmertemperatur ist dieser Anteil vernachlässigbar klein.
Welche Rolle spielt nun das Wasser?
Leitet man gasförmigen Chlorwasserstoff auf oder in Wasser, ist die Wahrscheinlichkeit für eine Dissoziation der HCl-Moleküle in Protonen und Chlorid-Ionen um ein Vielfaches höher. Dann läuft nämlich folgende Reaktion ab:
$HCl_{(aq)} + H_{2}O_{(l)} \to H_{3}O^{+}_{(aq)} + Cl^{-}_{(aq)}$
Wasser-Moleküle haben am O-Atom zwei freie Elektronenpaare. Damit können Teilchen mit einer leeren Kugelwolke leicht gebunden werden, vor allem, wenn diese Teilchen auch noch positiv geladen sind. Protonen erfüllen genau diese Bedingung: Sie haben eine leere Kugelwolke und sind positiv geladen.
Ein Proton kann sich mit seiner leeren Kugelwolke an eine der beiden doppelt besetzten Kugelwolken des Sauerstoff-Atoms setzen. Zwar ist das O-Atom des H2O-Moleküls nicht negativ geladen, es ist aber sehr elektronegativ und trägt daher eine recht starke negative Teilladung. Jedenfalls genug, um die positiv geladenen Protonen anzuziehen.
$H^{+} + H_{2}O \rightarrow H_{3}O^{+}$
Auf diese Weise entsteht ein Oxonium-Ion H3O+.
Wenn sich ein Oxonium-Ion aus einem Wasser-Molekül und einem Proton bildet, entsteht eine neue kovalente Bindung. Solche Prozesse setzen immer einen gewissen Energiebetrag frei (die Spaltung einer Bindung kostet ja Energie, dann muss ja bei der Bildung einer Bindung diese Energie wieder freigesetzt werden).
Die Energie, um eine O-H-Bindung zu spalten, beträgt 463 kJ/mol. Also werden bei der Bildung des Oxonium-Ions diese 463 kJ/mol freigesetzt. Das sind 32 kJ/mol mehr, als zur Spaltung der H-Cl-Bindung notwendig sind. Nun sollte eigentlich klar sein, wieso die Heterolyse des HCl-Moleküls durch Wasser-Moleküle erleichtert wird.
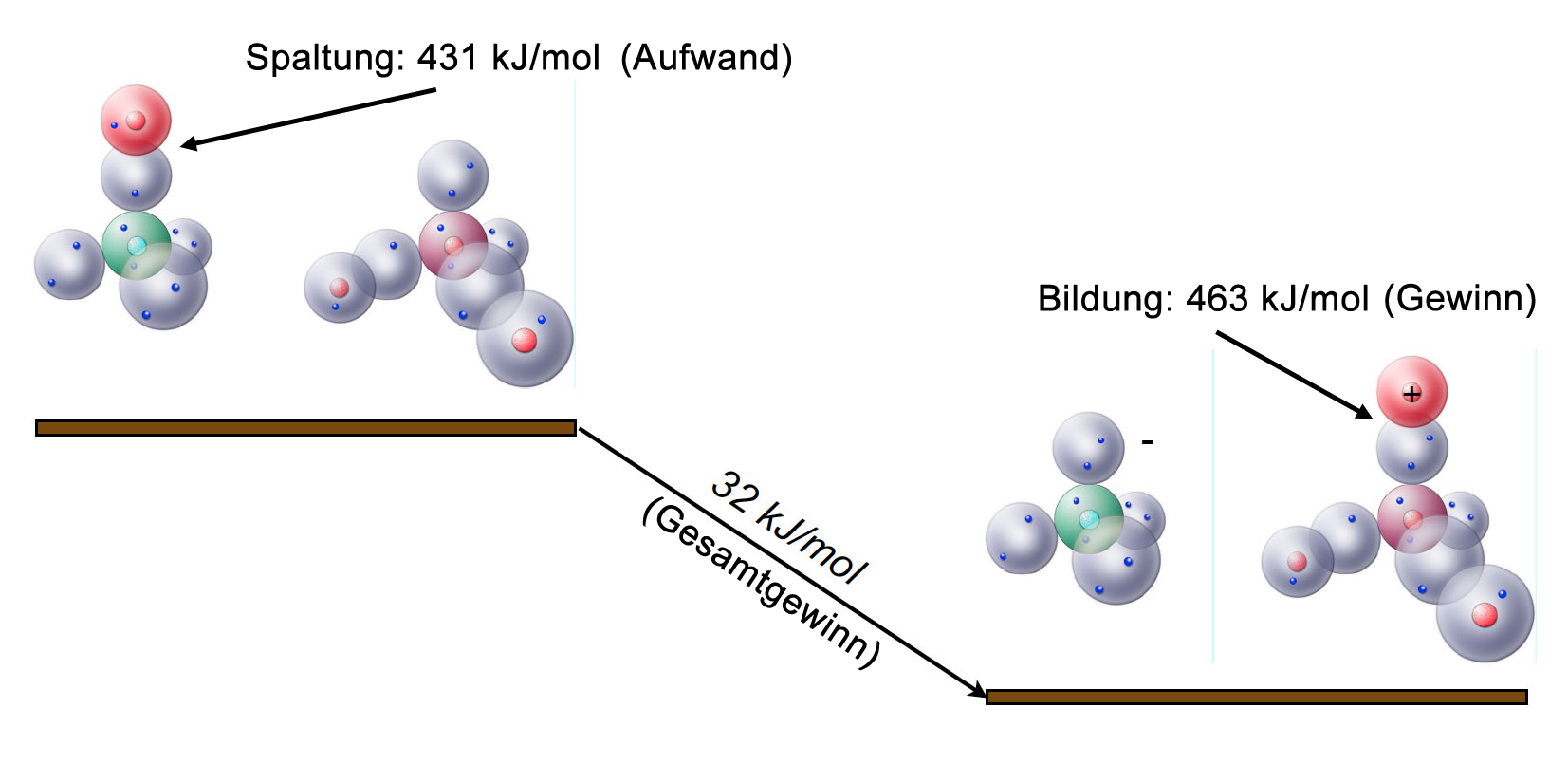
Durch das "Wandern" des Protons vom HCl zum H2O-Molekül werden insgesamt 32 kJ/mol gewonnen. Es handelt sich also um eine exotherme Reaktion, deren Aktivierungsenergie offenbar so niedrig ist, dass sie beim Einleiten von HCl in Wasser bei Zimmertemperatur spontan und schnell abläuft.
Wir ergänzen also die obige Reaktionsgleichung zu
$HCl_{(aq)} + H_{2}O_{(l)} \to H_{3}O^{+}_{(aq)} + Cl^{-}_{(aq)} \qquad \Delta H = -32kJ/mol$
Diese "Protonenwanderung" von einem Protonen-Donator (hier HCl) zu einem Protonen-Akzeptor (hier H2O) wird übrigens Protolyse genannt. "Protolyse" ist ein ganz wichtiger Fachbegriff, der garantiert auch im Chemie-Abitur drankommt, wenn Ihnen eine Aufgabe zur Säure-Base-Chemie vorgelegt wird.
Die Reaktion von Ammoniak mit Wasser ist endotherm
Jetzt denken Sie wahrscheinlich: Das ist immer so. Wenn eine Protolyse abläuft, "wandern" die Protonen vom Donator zum Akzeptor, weil dies energetisch günstiger ist. Bei der Reaktion zwischen Chlorwassestoff und Wasser ist das zufällig auch so. Schauen wir uns nun aber eine andere Reaktion an, die Umsetzung von Ammoniak mit Wasser.
$NH_{3_{(aq)}} + H_{2}O_{(l)}\to NH_{4_{(aq)}}^{+} + OH^{-}_{(aq)} $
Bei dieser Reaktion wandert ein Proton vom Wasser zum Ammoniak, und es entstehen ein Hydroxid-Ion OH- und ein Ammonium-Ion NH4+. Das Wasser ist hier also der Protonen-Donator, während das Ammoniak die Rolle des Protonen-Akzeptors spielt.
Das Ammoniak-Molekül hat eine doppelt besetzte Kugelwolke, in die sich leicht ein Proton hineinsetzen kann. Die Spaltung der O-H-Bindung im Wasser-Molekül kostet 463 kJ/mol, bei der Bildung einer N-H-Bindung werden aber nur 391 kJ/mol freigesetzt, rein energetisch betrachtet ist der Vorgang mit einer Reaktionsenthalphie von +72 kJ/mol also endotherm.
$NH_{3_{(aq)}} + H_{2}O_{(l)}\to NH_{4_{(aq)}}^{+} + OH^{-}_{(aq)} \qquad \Delta H = +72kJ/mol$
Offensichtlich sind die Bindungsdissoziationsenergien der Cl-H-, der N-H- und der O-H-Bindungen nicht allein für den Reaktionsverlauf verantwortlich. Ein weiterer Faktor spielt eine wichtige Rolle. Aber was könnte das für ein Faktor sein? Lassen wir uns überraschen.
Energetische Betrachtungen, Teil 2
Hydratisierung
Wenn ein HCl-Molekül dissoziiert, entstehen ein positives Proton und ein negatives Chlorid-Ion. Wasser-Moleküle sind bekanntlich Dipole, haben also ein positiv und ein negativ geladenes Ende. Daher gruppieren sich sofort viele Wasser-Dipole um ein Ion, wenn sich dieses im Wasser aufhält. Kationen, also positive Ionen wie das Proton, umgeben sich mit einer Hülle aus Wasser-Molekülen, wobei die negativen Enden der Wasser-Moleküle zum Kation hin gerichtet sind. Anionen, also negative Ionen wie das Chlorid-Ion oder das Hydroxid-Ion, werden ebenfalls von Wasser-Molekülen "umzingelt", allerdings drehen sich die Wasser-Moleküle so, dass sie mit ihren positiven Enden zum Anion hinweisen. Eine solche Hülle aus Wasser-Molekülen bezeichnet man Hydrathülle, den Vorgang selbst als Hydratisierung.
Bei einer solchen Hydratisierung entstehen neue chemische Bindungen zwischen den Wasser-Molekülen und den Ionen. Immer dann, wenn eine neue chemische Bindung entsteht, wird Energie freigesetzt.
Das ist ja auch logisch, denn immer dann, wenn eine Bindung gespalten wird, muss Energie aufgewandt werden. Die Bildung einer neuen Bindung ist das Gegenteil einer Bindungsspaltung, und wenn bei der Bindungsspaltung Energie aufgewandt werden muss, dann wird bei der Bildung einer neuen Bindung umgekehrt Energie freigesetzt.
Hydrationsenergie
Die Energie, die während der Bildung einer Hydrathülle freigesetzt wird, bezeichnet man als Hydrationsenergie. Hier eine Auflistung der für die beiden hier besprochenen chemischen Reaktionen wichtigen Hydrationsenergien:
- H3O+= -1085 kJ/mol
- Cl- = -380 kJ/mol
- OH- = -365 kJ/mol
- NH4+ = -293 kJ/mol
Sie sehen schnell, dass die bei der Hydration freigesetzten Energiebeträge wesentlich größer sind, als die "nackte" Reaktionsenthalpie der Protonenübertragung. Im Grunde spielt diese Reaktionsenthalpie nur eine untergeordnete Rolle. Entscheidend für den spontanen Ablauf der Säure-Base-Reaktion von HCl mit Wasser und von NH3 mit Wasser ist die Bildung von Ionen und deren Hydration.