7.1 Furan und Thiophen sind Aromaten
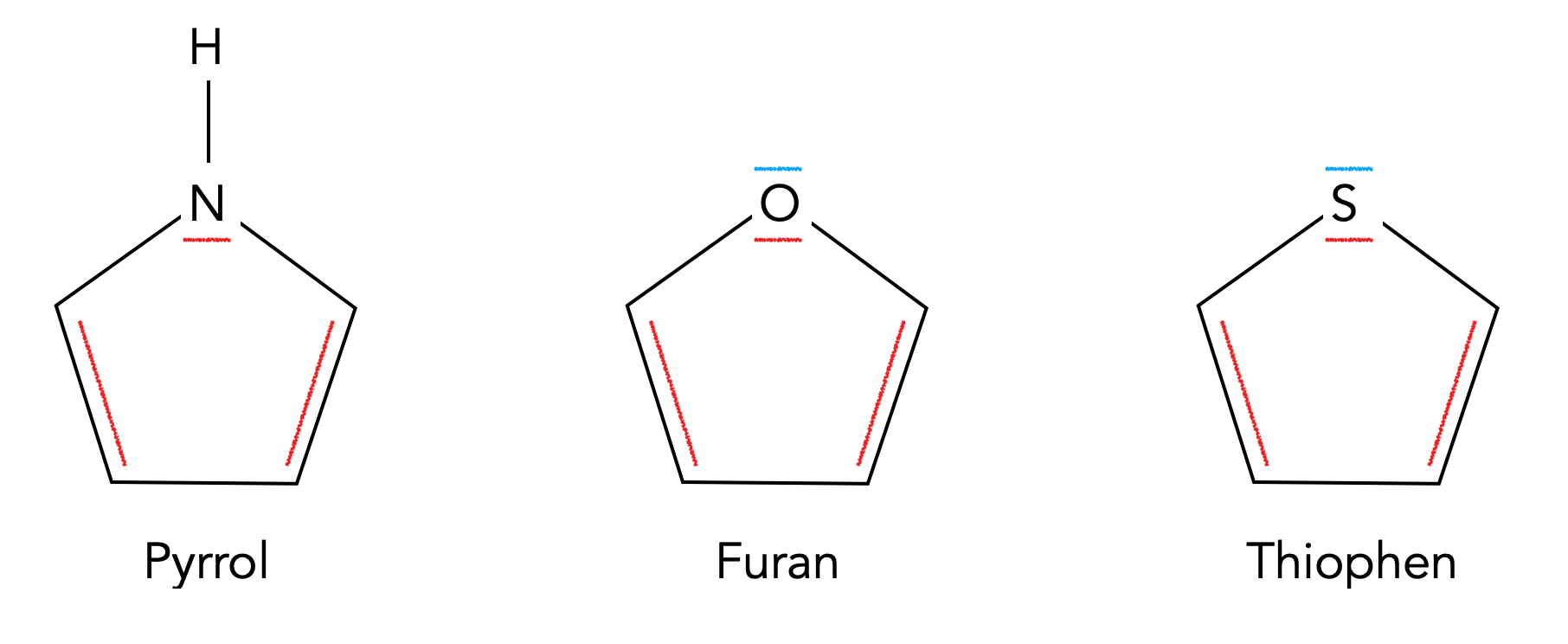
Pyrrol, Furan und Thiophen
Autor: Ulrich Helmich 12/2023, Lizenz: CC BY-NC-SA 4.0
Furan und Thiophen sind ähnlich aufgebaut wie das Pyrrol, nur haben sie als Hetero-Atom ein Sauerstoff- bzw. ein Schwefel-Atom in dem Fünferring sitzen.
Im Gegensatz zu Stickstoff haben Sauerstoff und Schwefel zwei freie Elektronenpaare, von denen sie aber nur eines dem aromatischen System zur Verfügung stellen. Das andere freie Elektronenpaar ragt als sp3-Hybridorbital aus dem Molekül nach außen heraus und verleiht den Stoffen dadurch die Eigenschaften einer Lewis-Base.
Allerdings gibt es einen wichtigen Unterschied zwischen Furan und Thiophen. Während sich die freien Elektronenpaare des Furans in einem 2pz bzw. 2sp3-Orbital befinden, sitzen die freien Elektronenpaare des Thiophens in einem größeren 3pz bzw. 3sp3-Orbital. Ein großes 3pz-Orbital überlappt aber mit den kleineren 2pz-Orbitalen der C-Atome nicht so gut wie ein 2pz-Orbital. Daher ist der aromatische Charakter von Thiophen etwas weniger stark ausgeprägt als der von Furan, und das schlägt sich auch in der Reaktivität gegenüber Elektrophilen nieder: Thiophen ist von allen drei Verbindungen die reaktionsträgste, Furan kommt an zweiter Stelle, und Pyrrol ist am reaktivsten, was die elektrophile Substitution angeht.
7.2 Elektrophile Addition möglich
Aus dem Schulunterricht kennen Sie vielleicht noch die Bromierung von Benzol. Nachdem sich der sigma-Komplex gebildet hat, gibt es im Prinzip zwei Möglichkeiten der Weiterreaktion. Die eine Möglichkeit ist die Addition eines Nucleophils an das positiv geladene Kation, die andere Möglichkeit ist die Abspaltung eines Protons. Nur die zweite Möglichkeit stellt den aromatischen Charakter der Verbindung wieder her. Bei der ersten Variante handelt es sich dagegen um eine "normale" elektrophile Addition. Daher findet fast ausschließlich die SE statt und nicht die Konkurrenzreaktion AE.
Bei Furan ist das allerdings etwas anders [3]. Gibt man Furan mit Brom in einem nicht-protischen Lösemittel zusammen, bildet sich wie erwartet Bromfuran in einer SE-Reaktion.
Verwendet man aber ein protisches Lösemittel wie Methanol, findet eine elektrophile Addition AE statt. Allerdings wird nicht - wie vielleicht erwartet - das Br2-Molekül addiert, sondern die Methanolat-Ionen:

Eine Furan-Bromierung gelingt nicht in Methanol als Lösemittel
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
Der σ-Komplex mit einem Br-Atom bildet sich zwar noch, das Kation wird dann aber von den CH3O--Anionen des Lösemittels Methanol angegriffen, und das Br-Atom wird durch ein CH3O--Anion substituiert.
Allerdings läuft die Reaktion noch einen Schritt weiter. Das Brom-Atom wird nämlich von dem Sauerstoff als Br- herausgedrängt, und es entsteht ein neues Kation. An dieses lagert sich dann ein zweites CH3O--Anion an:

Eine Furan-Bromierung gelingt nicht in Methanol als Lösemittel
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
So entsteht ein zweifaches Acetal, das als reaktiver Baustein in vielen weiteren organischen Synthesen eingesetzt werden kann.
Thiophen
Thiophen reagiert ähnlich wie Furan bei SE-Reaktionen, ist allerdings nicht so reaktiv wie Furan, weil das große 3pz-Orbital des Schwefel-Atoms nicht so perfekt mit den kleineren 2pz-Orbitalen der C-Atome überlappen kann.
Eine Reaktion des Thiophens, die in [2] und [5] erwähnt werden, sind die folgende:

Einige Reaktionen des Thiophens
Autor: Ulrich Helmich 01/2024, Lizenz: siehe Seitenende
Interessant ist, was man in [5] über die Versuchsanleitung zur Synthese von 2-Chlorsulfonyl-thiophen (die Reaktion ganz unten in der Abbildung) lesen kann:
"33,6 (0,4 mol) Thiophen dosiert man bei 20º unter Rühren zu einer Mischung aus 66 ml (1 mol) Chlorsulfonsäure und 83 g (0,4 mol) Phosphor(V)-chlorid; danach wird sofort in Eis/Wasser gegossen. Der kristalline Niederschlag wird abgesaugt und über Phosphor(V)-oxid getrocknet; Ausbeute 61 g (83%); Schmp.: 27-30º"
Es kann gut sein, dass Sie in einem Organik-Praktikum ähnliche Versuchsvorschriften bekommen und dass anschließend vom Assistenten nachgewogen wird, ob Sie tatächlich die angegebene Ausbeute erzielt haben.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Houben-Weyl, Methoden der Organischen Chemie, Band Hetarenes I, Part 1, 4. Auflage, Stuttgart 1994.
Seitenanfang -
Weiter mit Heterocylen mit mehr als einem N-Atom...