Die meisten Enzyme (mehr als 60%) [1] haben nicht ein Substrat, sondern zwei oder sogar drei Substrate.
Beispiel Aminoacyl-tRNA-Synthetasen
Die Aminoacyl-tRNA-Synthetasen sind Enzyme, die eine tRNA spezifisch mit einer bestimmten Aminosäure verbinden und dabei ATP als "Treibstoff" benötigen. Eine solche Aminoacyl-tRNA-Synthetase besitzt drei aktive Zentren: Eins für die tRNA, eins für die Aminosäure, und eins für das ATP-Molekül.
Die meisten Enzyme jedoch katalysieren eine Reaktion wie
$A + B \rightleftharpoons X + Y$
Zwei Substrate A und B reagieren zu einem Produkt X oder zu zwei Produkten X und Y.
Sequentielle Verdrängung
Bei diesem Mechanismus müssen beide Substrate an ihre aktiven Zentren binden, bevor es zur enzymatischen Reaktion kommt. Es bildet sich ein Enzym-Produkt-Komplex aus drei Komponenten, ein ternärer Komplex also: A-E-B oder E-A-B oder E-B-A, je nachdem, wie die aktiven Zentren organisiert sind. Erst wenn beide Substrate gebunden sind, können die Produkte oder das Produkt gebildet und freigesetzt werden.
Bei dieser sequentiellen Verdrängung kann man noch weiter unterscheiden:
- Beide Substrate müssen gleichzeitig an das Enzym binden
- Die beiden Substrate binden nacheinander an das Enzym, erst A, dann B oder umgekehrt.
- Beide Substrate können in einer zufälligen Reihenfolge nacheinander an das Enzym binden.
Mit Hilfe der sogenannten Cleland-Schreibweise kann man diese verschiedenen Mechanismen graphisch veranschaulichen.
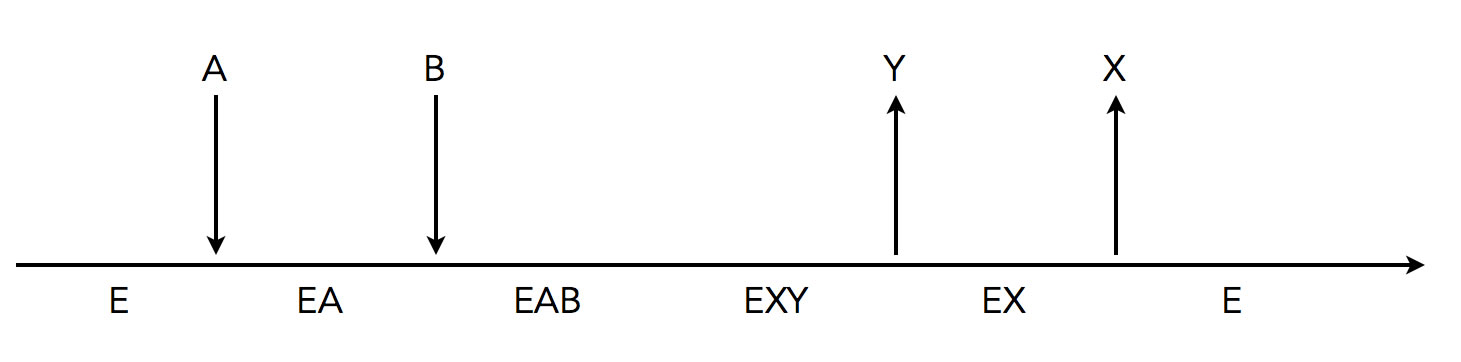
Cleland-Schreibweise einer enzymatischen Reaktion
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Aufgabe 1:
Wie würden Sie diese Enzymreaktion beschreiben?
Lösungsvorschlag:
Das Enzym E verbindet sich zunächst mit dem Substrat A zum Enzym-Substrat-Komplex EA. Erst danach setzt sich das zweite Substrat B in das aktive Zentrum, es bildet sich der ternäre Komplex EAB.
Nun kommt es zur enzymatischen Reaktion, aus den beiden Edukten A und B werden die beiden Produkte X und Y.
Das Produkt Y wird zuerst freigesetzt, dann erst das Produkt X. Danach liegt das Enzym wieder in seiner ursprünglichen Form vor.
Beispiel:
Ein Beispiel aus dem Glucose-Stoffwechsel ist die Lactat-Dehydrogenase, die Pyruvat, das Endprodukt der Glycolyse, zu Lactat reduziert und dazu das Coenzym NADH benötigt. Das NADH setzt sich zuerst in das aktive Zentrum, und dann das Pyruvat. Dann findet die Reaktion statt und das Produkt Lactat wird zuerst freigesetzt, danach dann das oxidierte NAD+.
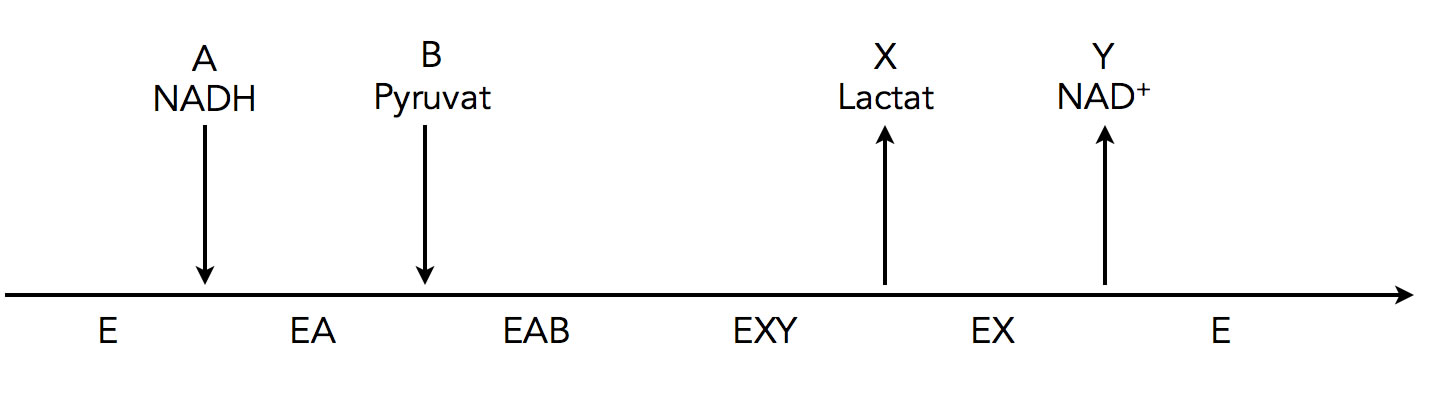
Konkretes Beispiel 1
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Kommen wir zu einem anderen Typus der sequentiellen Verdrängung.
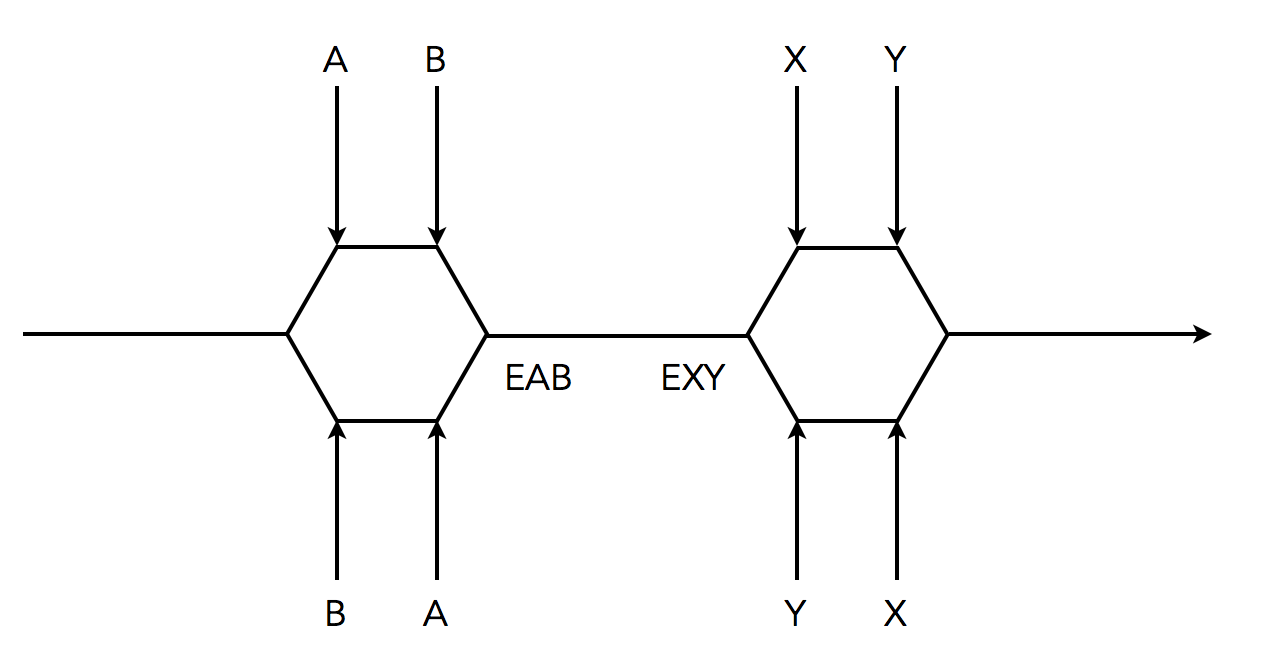
Eine weitere Enzymreaktion in der Cleland-Schreibweise
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Aufgabe 2:
Wie würden Sie diese Enzymreaktion beschreiben?
Die beiden Substrate A und B müssen nicht gleichzeitig an das Enzym binden, sondern nacheinander. Dabei ist die Reihenfolge jedoch dem Zufall überlassen. Es kann also zuerst A und dann B binden oder umgekehrt zuerst B und dann A. Auf jeden Fall bildet sich danach der ternäre Komplex EAB, der zum EXY-Komplex reagiert.
Bei der Freisetzung der beiden Produkte X und Y wiederholt sich jetzt das Spiel: Entweder wird zuerst X und dann Y freigesetzt oder umgekehrt.
Beispiel:
Ein Beispiel für diese Art der sequentiellen Verdrängung ist die Phosphorylierung von Kreatin zu Kreatinphosphat. Bei der Reaktion kann zuerst das ATP an das Enzym binden und dann das Kreatin, oder die Reihenfolge kann genau umgekehrt sein. Auch bei der Freisetzung der Produkte sind beide Reihenfolgen möglich: Zuerst Kreatinphosphat und dann ATP, oder zuerst ATP und dann Kreatinphosphat.
Pingpong-Reaktion
In der Pingpong-Reaktion, die auch als doppelte Verdrängung bezeichnet wird, gibt es keinen ternären Komplex als Zwischenprodukt der enzymatischen Reaktion. Vielmehr wird das Enzym E selbst verändert, es ensteht ein enzymatisches Zwischenprodukt, das wir hier einfach mal als F bezeichnen. Ein schönes Beispiel für eine solche Pingpong-Reaktion ist die Übertragung einer Aminogruppe von Aspartat auf alpha-Ketoglutarat. Diese Reaktion sieht im Cleland-Schema folgendermaßen aus:
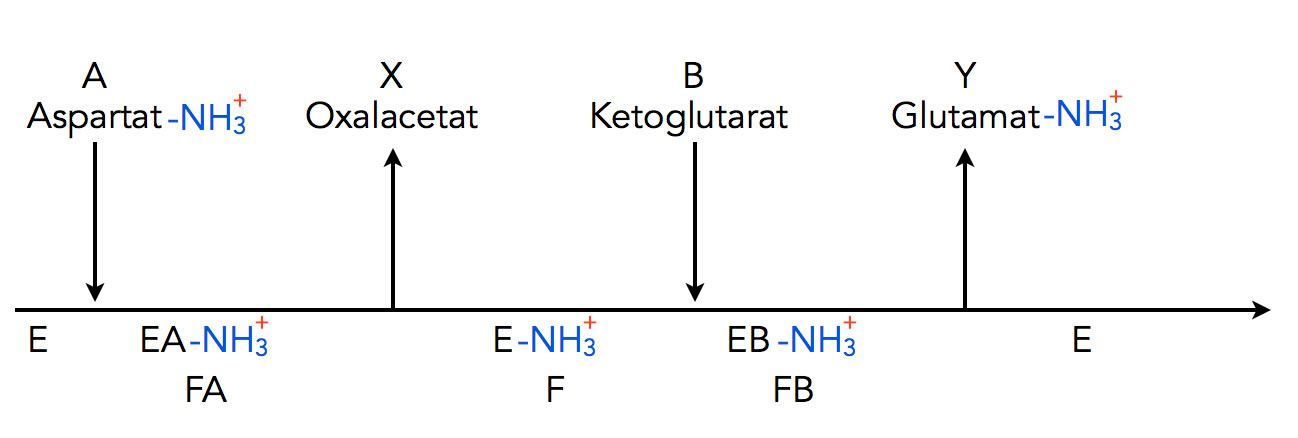
Eine Pingpong-Reaktion im Cleland-Schema
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Das Enzym Aspartat-Aminotransferase (E) bindet zunächst das Aspartat. Die positiv geladene Aminogruppe des Aspartats wird dabei kovalent auf das Enzym übertragen. Das Enzym E reagiert also zu einer modifizierten Verbindung E-NH3+ oder einfach F.
Im nächsten Schritt wird das Produkt Oxalacetat abgegeben, die Aminogruppe verbleibt aber noch im Enzym. Jetzt kommt das Ketoglutarat dazu, das zweite Edukt. Das modifizierte Enzym F überträgt jetzt die Aminogruppe auf das Ketoglutarat, dabei entsteht das zweite Produkt Glutamat, das anschließend freigesetzt wird. Da das Enzym jetzt die Aminogruppe wieder abgegeben hat, liegt es in der ursprünglichen Form E vor.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.