Unter Langzeitpotenzierung (LTP, von engl. long term potentiation) versteht man eine Form der synaptischen Plastizität, bei der sich die Übertragungsstärke einer Synapse langfristig erhöht, wenn diese Synapse immer wieder erregt wird. Langzeitpotenzierung steht also in unmittelbarem Zusammenhang mit Lernen und Langzeitgedächtnis.
Das Phänomen der Langzeitpotenzierung wurde an bestimmten Neuronen im Gehirn experimentell nachgewiesen. All diese Neuronen haben eines gemeinsam: Sie benutzen Glutamat als Neurotransmitter, und in der postsynaptischen Membran sitzen bestimmte Glutamat-Rezeptoren, nämlich die AMPA-Rezeptoren und die NMDA-Rezeptoren.
Auf dieser Seite finden Sie viele Informationen zu Nervenzellen, deren Neurotransmitter Aminosäuren wie Glutamat, Glycin oder gamma-Aminobuttersäure (GABA) sind. Auch auf die Rezeptoren für diese Neurotransmitter wird hier eingegangen.
Zunächst einmal stellen wir uns vor, dass in der postsynaptischen Membran beide Typen von Glutamat-Rezeptoren sitzen, sowohl die AMPA-Rezeptoren wie auch die NMDA-Rezeptoren. Beide Rezeptortypen sind direkt mit Ionenkanälen verbunden, so wie wir es auch von der motorischen Endplatte kennen, es handelt sich also um ionotrope Rezeptoren (im Gegensatz zu metabotropen Rezeptoren, die über G-Proteine wirken).
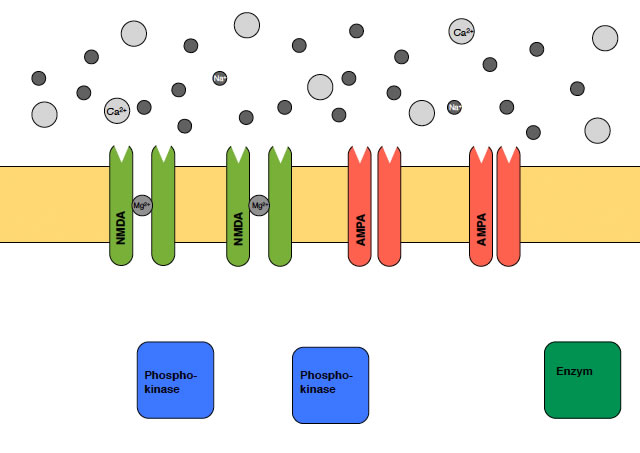
NMDA- und AMPA-Rezeptoren in der postsynaptischen Membran
Autor: Ulrich Helmich, Lizenz: Public domain
Allerdings sind die NMDA-Kanäle durch Magnesium-Ionen verschlossen, wie die Zeichnung oben zeigt. Bei den Ionenkanälen der AMPA-Rezeptoren ist das nicht der Fall, hier können die Calcium-Ionen (und Natrium-Ionen) ungehindert einströmen, wenn die Kanäle durch Glutamat aktiviert werden:
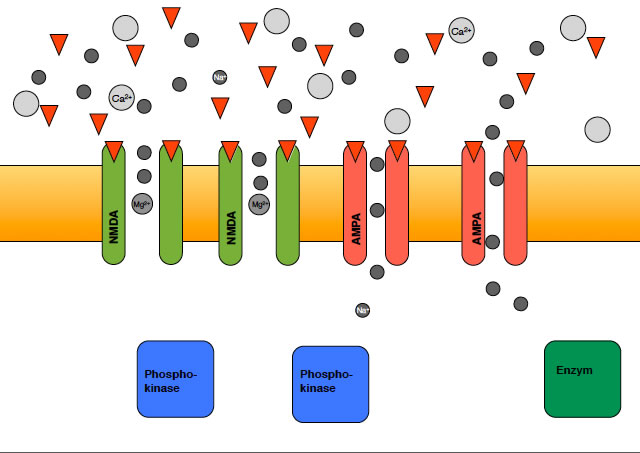
Die Kationenkanäle der AMPA-Rezeptoren werden durch Glutamat geöffnet
Autor: Ulrich Helmich, Lizenz: Public domain
Auf diesem Bild sieht man, wie Natrium-Ionen durch die aktivierten AMPA-Kanäle in die postsynaptische Zelle einströmen. Die NMDA-Kanäle sind aber noch verschlossen.
Durch das Einströmen der Natrium-Ionen wird die Membran depolarisiert, was ich hier durch den leichten Farbverlauf angedeutet habe. Durch die Depolarisierung werden die Magnesium-Ionen aus den NMDA-Kanälen heraus gedrängt, und Calcium-Ionen können in die Zelle eindiffundieren, wie man auf dem nächsten Bild gut sehen kann:
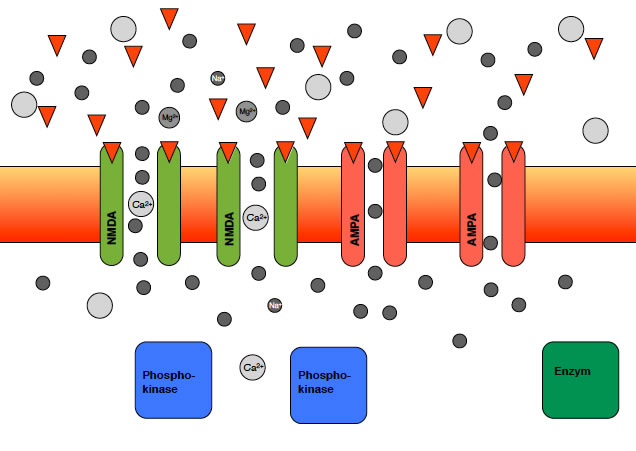
NMDA- und AMPA-Rezeptoren in der postsynaptischen Membran
Autor: Ulrich Helmich, Lizenz: Public domain
Mechanismus der Kurzzeitpotenzierung
Die einströmenden Calcium-Ionen depolarisieren die Membran noch etwas stärker, haben aber eine viel wichtigere Rolle bei der Langzeitpotenzierung.
Man bedenke, dass die Ca2+-Konzentration innerhalb und außerhalb der Zelle viel geringer ist als die Na+- und die K+-Konzentration. Daher tragen einströmende Ca2+-Ionen nur sehr gering zur Depolarisierung der Membran bei.
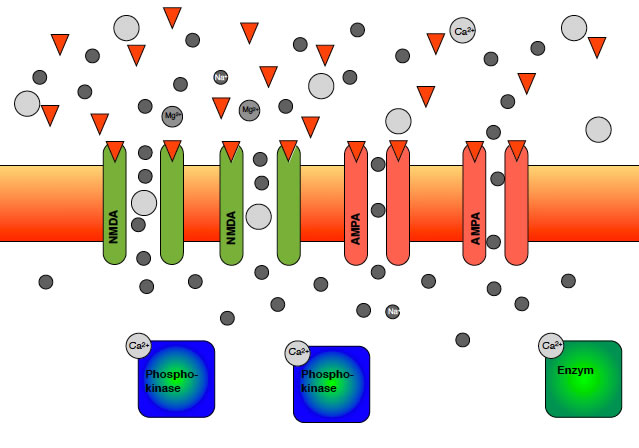
NMDA- und AMPA-Rezeptoren in der postsynaptischen Membran
Autor: Ulrich Helmich, Lizenz: Public domain
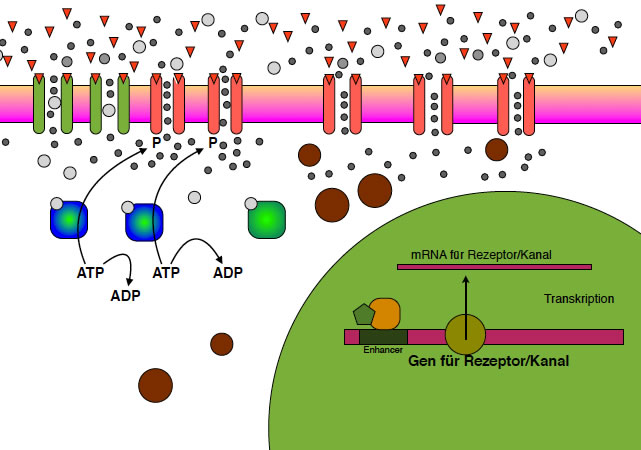
Die Calcium-Ionen setzen sich an bestimmte Enzyme des Cytoplasmas der postsynaptischen Zelle, vor allem an Proteinkinasen. Proteinkinasen sind Enzyme, die ein ATP-Molekül in ADP und Phosphat spalten. Das Phosphat hängen sie dann an ein anderes Protein an und aktivieren dies dadurch. Vor allem die Proteinkinase C muss hier genannt werden.
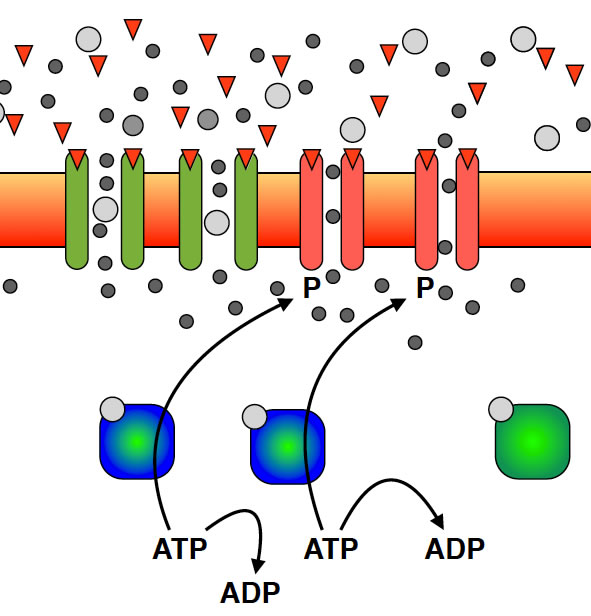
AMPA-Rezeptoren werden durch Phosphat zusätzlich aktiviert
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sieht man zwei Proteinkinasen in Aktion. Die Phosphat-Ionen werden an die AMPA-Kanäle "angehängt", dadurch steigt deren Durchlässigkeit für Calcium- und Natrium-Ionen.
Der bisher beschriebene Mechanismus erklärt also ganz gut, wie es zu einer Kurzzeitpotenzierung kommen kann. Kurzzeitpotenzierungen sind Verstärkungen der synaptischen Übertragung für einige Sekunden bis wenige Minuten. Solche Kurzzeitpotenzierungen spielen höchstwahrscheinlich bei dem Kurzzeitgedächtnis eine wichtige Rolle.
Retrograde Botenstoffe
Die erhöhte Calcium-Ionen-Konzentration im Zellplasma aktiviert bei manchen Synapsen auch einen weiteren interessanten Signalweg. Die postsynaptische Zelle setzt sogenannte retrograde Botenstoffe frei, zum Beispiel Stickstoffmonoxid (NO). Das NO diffundiert dann ins Endknöpfchen der präsynaptischen Zelle und erhöht dort die Transmitterausschüttung. Auch so wird die Signalübertragung der Synapse kurzfristig gestärkt.
Bei der Kurzzeitpotenzierung an bestimmten Glutamat-Synapsen wird bei längerer Depolarisierung der postsynaptischen Membran (verursacht durch zeitliche oder räumliche Summation) die Natrium-Permeabilität bestimmter Ionenkanäle verstärkt, so dass die gleiche Neurotransmitter-Menge einen verstärkten Effekt zur Folge hat. Über einen retrograden Signalweg (NO) kann auch die Transmitterausschüttung erhöht werden.
Langzeitpotenzierung
Kommen wir nun zur Langzeitpotenzierung. Wie kann die Verbindungsstärke einer Synapse auf Dauer gesteigert werden? Schauen wir uns dazu das nächste Bild an:
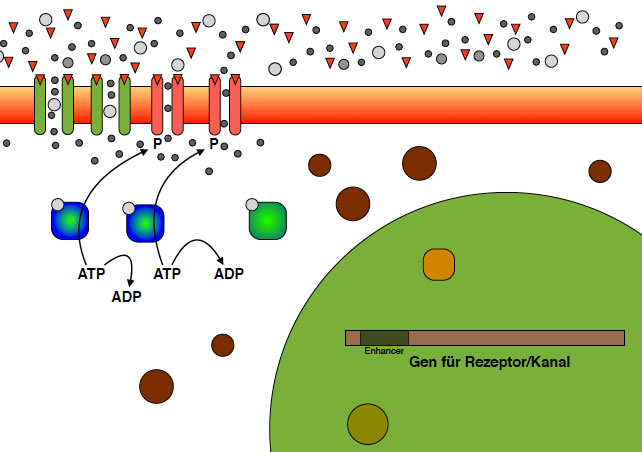
NMDA- und AMPA-Rezeptoren werden durch bestimmte Gene codiert
Autor: Ulrich Helmich, Lizenz: Public domain
Die virtuelle Kamera geht jetzt mal etwas weiter zurück, so dass wir auch einen Teil des Zellkerns der postsynaptischen Zelle sehen können. In diesem Zellkern befindet sich die DNA mit den über 25.000 Genen, von denen ich aber nur eins eingezeichnet habe, nämlich ein Gen für den AMPA-Rezeptor/Kanal (es handelt sich ja um ein Protein mit zwei Bereichen, einem Rezeptor-Bereich und einem Kanal-Bereich).
Die Darstellung ist stark vereinfacht - schließlich ist ja nicht die Molekulargenetik der Schwerpunkt dieser Seite, sondern die Neurobiologie. Daher bitte ich um Nachsicht, wenn ich den Enhancer direkt in das Gen eingezeichnet habe und nicht weit entfernt davon an irgendeiner anderen Stelle des Genoms.
Achten Sie nun auf das hellgrüne Enzym in der Mitte des Bildes, das bisher noch keine Rolle gespielt hat. Die dicken braunen Kugeln können Sie noch ignorieren, es handelt sich um die großen und kleinen Ribosomen-Untereinheiten, die ja für die Synthese der Proteine zuständig sind.
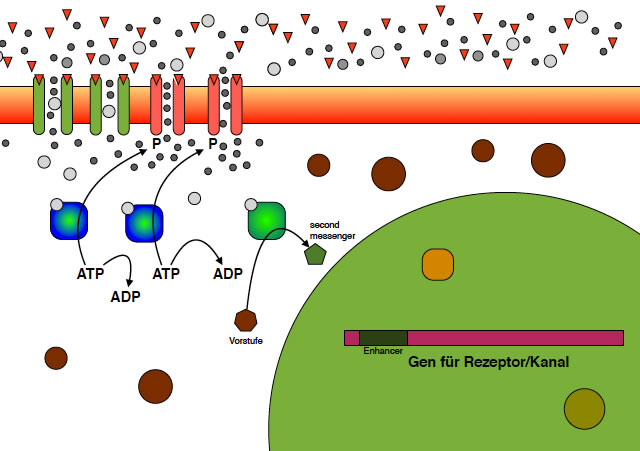
Bildung eines second messengers
Autor: Ulrich Helmich, Lizenz: Public domain
Dieses Enzym, das ebenfalls durch die eingedrungenen Calcium-Ionen aktiviert wird, stellt einen sekundären Botenstoff (second messenger) her, beispielsweise cAMP, cGMP oder Ähnliches. Da will ich mich jetzt nicht so genau festlegen, weil ich dazu noch keine näheren Informationen gefunden habe.
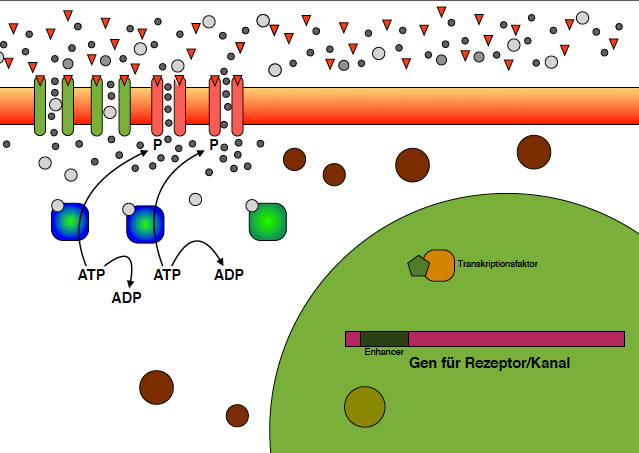
Der second messenger aktiviert einen Transkriptionsfaktor
Autor: Ulrich Helmich, Lizenz: Public domain
Nun ist der second messenger in den Zellkern transportiert worden (auf die entsprechenden Transportproteine verzichten wir hier der Einfachheit wegen). Im Zellkern aktiviert der second messenger einen Transkriptionsfaktor. Transkriptionsfaktoren sind Moleküle (oft Proteine, aber nicht immer), die sich an bestimmte regulatorische Bereiche der DNA setzen können. Bei Eukaryoten werden diese als enhancer oder silencer bezeichnet, je nachdem ob sie die Transkription eines Gens fördern oder hemmen.
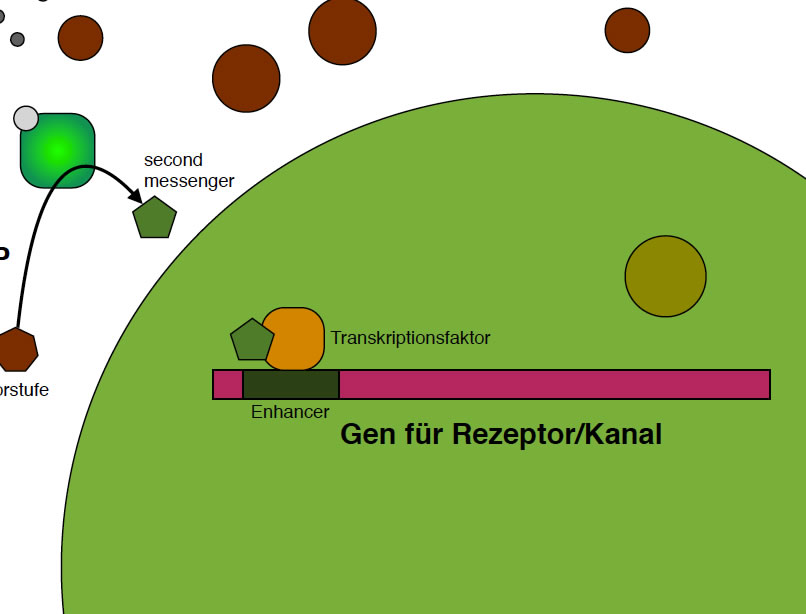
Der aktivierte Transkriptionsfaktor bewirkt die Transkription des Rezeptor/Kanal-Gens
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sieht man, wie sich der aktivierte Transkriptionsfaktor an den für das Rezeptor/Kanal-Gen zuständigen Enhancer gesetzt hat.
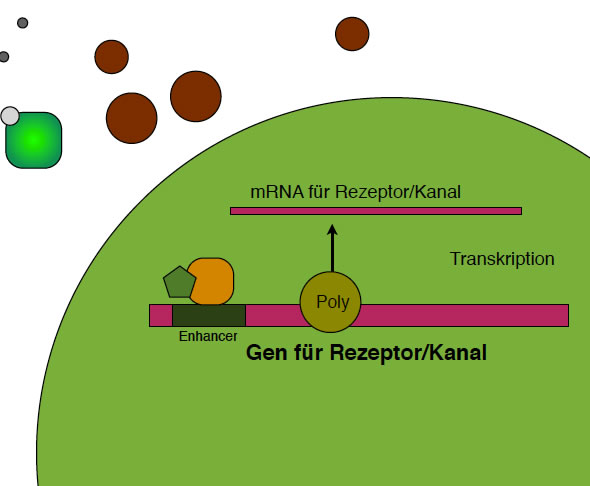
Die mRNA für den Rezeptor/Kanal wird von der DNA-Polymerase hergestellt
Autor: Ulrich Helmich, Lizenz: Public domain
Das Gen ist nun aktiviert worden, und die RNA-Polymerase führt die Transkription durch.
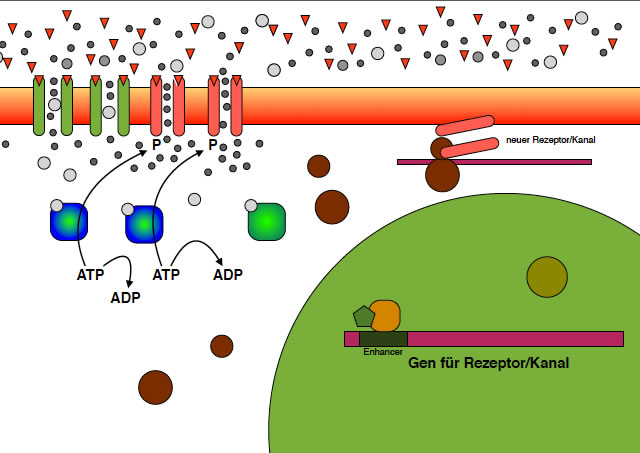
An den Ribosomen wird die mRNA für neue Rezeptor/Kanal-Proteine translatiert, also in Proteine übersetzt.
Autor: Ulrich Helmich, Lizenz: Public domain
An den Ribosomen werden nun neue AMPA-Rezeptoren/Kanäle hergestellt (Translation), die dann in die Zellmembran der postsynaptischen Zelle eingebaut werden.
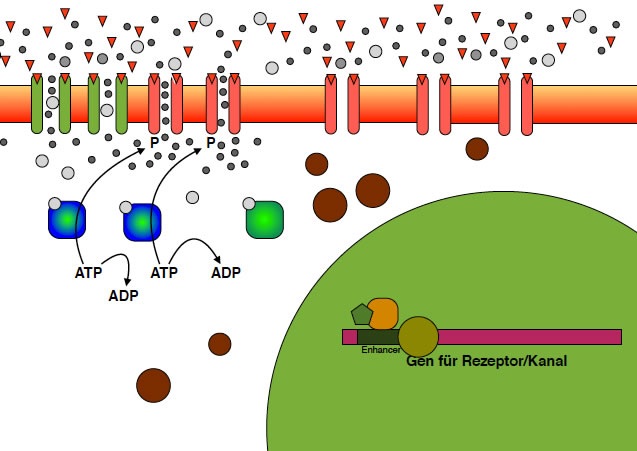
Die neuen Rezeptoren/Kanäle werden in die postsynaptische Membran eingebaut
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sieht man, wie drei neue AMPA-Kanäle in die Membran eingebaut wurden.
Die postsynaptische Membran enthält jetzt mehr AMPA-Rezeptoren/Kanäle
Autor: Ulrich Helmich, Lizenz: Public domain
Hier schließlich das letzte Bild. Die neuen AMPA-Kanäle arbeiten; Calcium- und Natrium-Ionen diffundieren durch sie hindurch in die Zelle und die Depolarisierung wird - bei gleicher Transmittermenge - noch stärker. Die Signalübertragung funktioniert also noch effektiver als zuvor, und zwar langfristig, nicht nur für Sekunden oder wenige Minuten, sondern für viele Minuten, Stunden oder sogar vielleicht Tage.
Bei der Langzeitpotenzierung an Glutamat-Synapsen bewirken die einströmenden Calcium-Ionen über second messenger eine Aktivierung bestimmter Gene im Zellkern, so dass neue Rezeptoren bzw. Ionenkanäle in die postsynaptische Membran eingebaut werden können, was die Signalübertragung an der Synapse effektiver macht.
Es gibt inzwischen viele Befunde zu den molekularen Mechanismen der Langzeitpotenzierung. Nach dem Physiologie-Buch von Gekle u.a. (Thieme-Verlag 2010) aktiviert das Calcium eine membranständige Adenylatcyclase, die den cAMP-Spiegel in der Zelle erhöht. Das cAMP setzt sich dann an bestimmte Proteinkinasen, welche in den Zellkern diffundieren und dort Transkriptionsfaktoren aktivieren. Im Wesentlichen stimmt dieses Bild als mit den Vorstellungen überein, die ich hier auf dieser Seite erläutert habe.