Ein Schlüsselprozess bei der ganzen Translation ist die Beladung der tRNAs mit der jeweils passenden Aminosäure.
So etwas geht nicht von allein, sondern wird durch Enzyme geregelt. Und zwar gibt es für jede der 20 Aminosäuren der Zelle ein eigenes Enzym, das diese Aminosäuren mit der passenden tRNA zusammenbringt. Diese Enzyme haben die komplizierte Bezeichnung Aminoacyl-tRNA-Synthetasen, weil sie Aminosäuren und tRNA zusammenbringen.
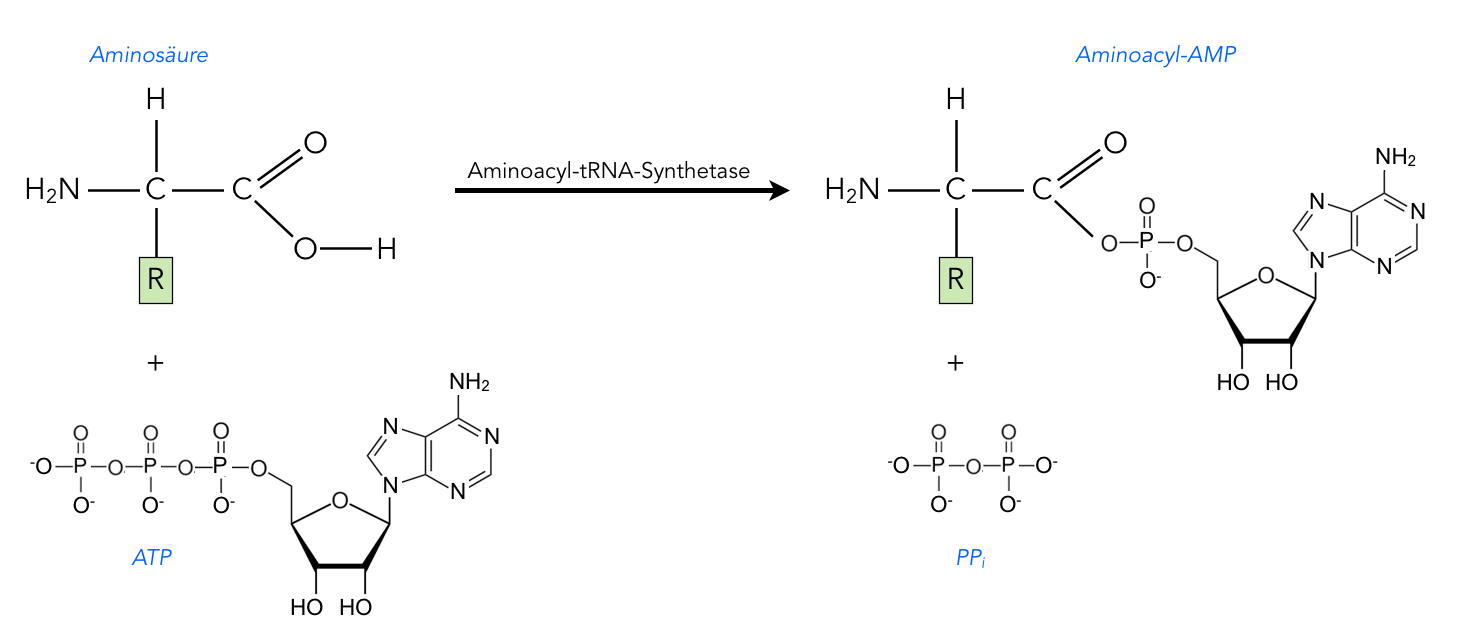
Aktivierung einer Aminosäure durch ATP
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir den ersten Schritt der Bildung einer beladenen tRNA, der durch die Aminoacyl-tRNA-Synthetase katalysiert wird [1]. Die Aminosäure muss zunächst aktiviert werden. Wie so oft, geschieht das mit Hilfe von ATP.
Bei einer normalen Phosphorylierung gibt ein ATP-Molekül eine Phosphatgruppe an das zu aktivierende Substrat ab. Aus Glucose und ATP entstehen so beispielsweise Glucose-6-Phosphat und ADP. Bei der Aktivierung der Aminosäure ist es etwas anders: Das ATP gibt zwei Phosphatgruppen in Form von Pyrophosphat PPi ab, und das übrig gebliebene AMP verbindet sich mit der Carboxygruppe der Aminosäure:
Aminosäure + ATP → Aminoacyl-AMP + PPi
Im zweiten Schritt der tRNA-Beladung wird der Aminoacyl-AMP-Komplex mit dem 3'-OH-Ende der tRNA verbunden. Das AMP wird dabei abgespalten, es findet also folgende Reaktion statt:
Aminoacyl-AMP + tRNA → Aminoacyl-tRNA + AMP
Eine Aminoacyl-tRNA-Synthetase muss also drei Bindungsstellen bzw. aktive Zentren besitzen.
- für die Aminosäure
- für das ATP
- für die tRNA
Alle drei Bindungsstellen müssen hochspezifisch sein. Dummerweise unterscheiden sich die 20 Aminosäuren voneinander nicht allzu stark, der Grundaufbau ist völlig gleich, nur die Reste sind unterschiedlich. Daher kann es schon einmal vorkommen, dass die Aminoacyl-tRNA-Synthetase eine falsche Aminosäure mit dem tRNA-Molekül verknüpft. Die Häufigkeit eines solchen Fehlers liegt je nach tRNA zwischen 0,1 und 0,5%. Allerdings verfügt das Enzym über Reparatur-Mechanismen, die entweder vor der Verknüpfung oder danach den Fehler erkennen und korrigieren [1].
Bei den tRNA-Molekülen sind die Aminoacyl-tRNA-Synthetasen nicht ganz so genau; bei einigen Aminoacyl-tRNA-Synthetasen können sich zwei, drei oder vier verschiedene tRNA-Moleküle in die Bindungsstelle setzen. Dies ist der Grund dafür, dass es für manche Aminosäuren mehrere verschiedene tRNAs mit unterschiedlichen Anticodons gibt. Meistens unterscheiden sich diese Anticodons aber nur in der letzten der drei Basen (siehe auch Wobble-Hypothese). Und das wiederum ist der Grund dafür, dass der genetische Code redundant ist, wie man sagt: Für ein- und dieselbe Aminosäure gibt es zwei, drei, vier, manchmal sogar sechs verschiedene tRNAs mit unterschiedlichen (aber ähnlichen) Anticodons - und daher gibt es auch bis zu sechs Codons für bestimmte Aminosäuren.
Quellen:
- Alfred Nordheim, Rolf Knippers: Molekulare Genetik, 11. Auflage, Thieme-Verlag Stuttgart 2018.
- Jochen Graw: Genetik, 7. Auflage, Springer Spektrum, Berlin 2021.
- engl. Wikipedia, Artikel "Aminoacyl-tRNA-Synthetase".