Kohlenhydrat-Stoffwechsel
Aus dem Biologie-Unterricht kennen Sie bestimmt noch die Glycolyse und den Citratzyklus. Falls nicht, sollten Sie sich die beiden wichtigen Stoffwechselprozesse schnell noch einmal anschauen.
Am Ende der Glycolyse - im Schritt 9 - steht das Pyruvat. Diese Verbindung muss in Acetyl-Coenzym A umgewandet werden, bevor sie in den Citratzyklus einfließen kann. Bei dieser Umwandlung spielt das Thiamin eine wesentliche Rolle.
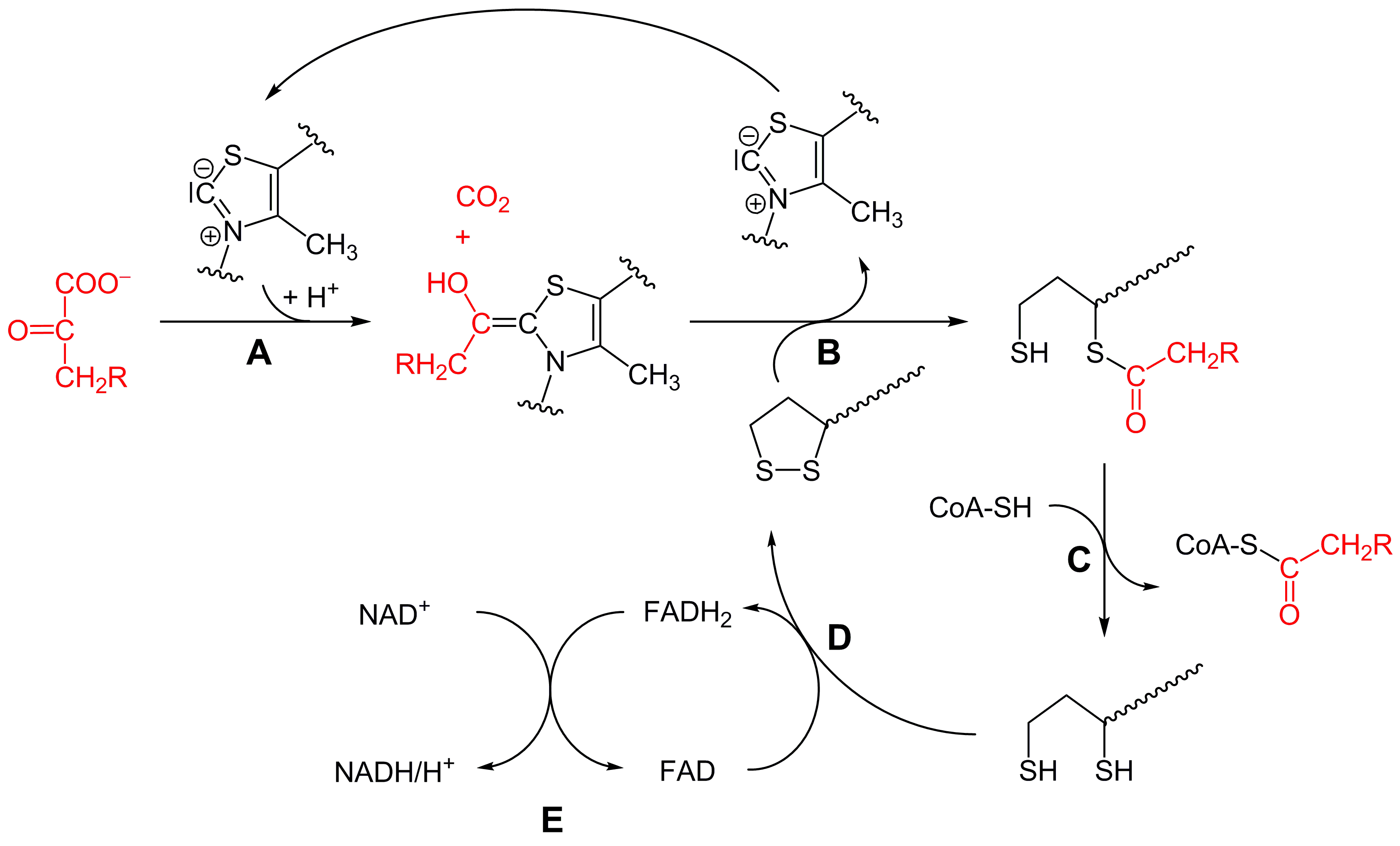
Schema der oxidativen Decarboxylierung. Für Pyruvat (R=H) wird dies vom Pyruvat-Dehydrogenase-Komplex katalysiert.
Yikrazuul, Public domain, via Wikimedia Commons
Teilschritt A [1,2]
Das Pyruvat (R = H) wird decarboxyliert, das heißt, die COOH-Gruppe wird als CO2-Molekül abgespalten, und der übrig gebliebene Rest des Pyruvats - im Grunde ein Ethanol-Molekül - wird auf den Thiazolring des Thiamins übertragen. Dieser Teilschritt wird durch das Enzym Pyruvat-Dehydrogenase katalysiert.
Das C-Atom des Thiazolringes, das sich zwischen dem N-Atom und dem S-Atom befindet, gibt sein H-Atom relativ leicht als Proton ab (pKS-Wert nur 10.1), zurück bleibt dann ein negativ geladenes Carbokation [4]. Mit diesem negativ geladenem C-Atom verbindet sich der Thiazolring mit dem positiv polarisierten mittleren C-Atom des Pyruvats. Chemisch gesehen handelt es sich dabei also um einen nucleophilen Angriff des Thiazolringes. Was vielleicht noch erwähnt werden sollte: Das Thiamin-Molekül liegt in zweifach phosphorylierter Form vor und wird daher als Thiaminpyrophosphat TPP bezeichnet.
Bereits dieser erste Teilschritt der Pyruvat-Decarboxylierung zeigt, wie wichtig Vitamin B1 für den Stoffwechsel ist. Fehlt dieses Vitamin, so kann das Pyruvat nicht in Acetyl-CoA umgewandelt werden und in den Citratzyklus einfließen. Ein Thiamin-Mangel hat somit einen erhöhten Pyruvat-Spiegel im Blut zur Folge.
Teilschritt B [1,2]
Die Ethanol-Gruppe wird vom Thiazolring des Thiamins auf Liponamid übertragen. Dabei wird der Alkohol wieder zum Keton oxidiert (aus C-OH wird C=O). Wenn man sich den gezeigten Teilschritt näher anschaut, sieht man auch, wer für diese Oxidation verantwortlich ist, nämlich die beiden Schwefel-Atome des Liponamids, diese werden bei der Reaktion reduziert. Außerdem wird das TTP bei diesem Schritt regeneriert und steht wieder für den Teilschritt A zur Verfügung. Auch für diesen Teilschritt ist das Enzym Pyruvat-Dehydrogenasezuständig.
Als Liponamid wird übrigens die ?-Liponsäure bezeichnet, die über eine Amidbindung fest an ein Enzym gebunden ist [3].
Teilschritt C [1,2]
Nun kommt der wichtige Teilschritt C, bei dem der Acetylrest vom Liponamid auf das Coenzym A übertragen wird, so dass Acetyl-CoA entsteht. Katalysiert wird dieser Schritt durch das Enzym Dihydrolipoyl-Transacetylase.
Teilschritt D
Damit das Liponamid für den nächsten Zyklus eingesetzt werden kann, müssen die beiden Schwefel-Atome wieder oxidiert werden. Als Oxidationsmittel wird dazu das Coenzym FAD eingesetzt, welches die beiden H-Atome von den Schwefel-Atomen übernimmt und dadurch zu FADH2 reduziert wird. Dieser Teilschritt und auch der nächste wird durch das Enzym Dihydrolipoyl-Dehydrogenase katalysiert.
Teilschritt E
Um neues FAD zu regenierieren, wird das FADH2 von NAD+ oxidiert. Dabei entsteht die reduzierte Form NADH/H+.
Im Expertenteil der Seite "Schritt 0" der Citratzyklus-Seiten wird diese Reaktion noch etwas genauer dargestellt.
Der Pyruvat-Dehydrogenase-Komplex
Die an der Bildung von Acetyl-Coenzym A beteiligten Enzyme und Cofaktoren bilden einen riesigen Multienzym-Komplex, der sogar größer ist als ein Ribosom [4].
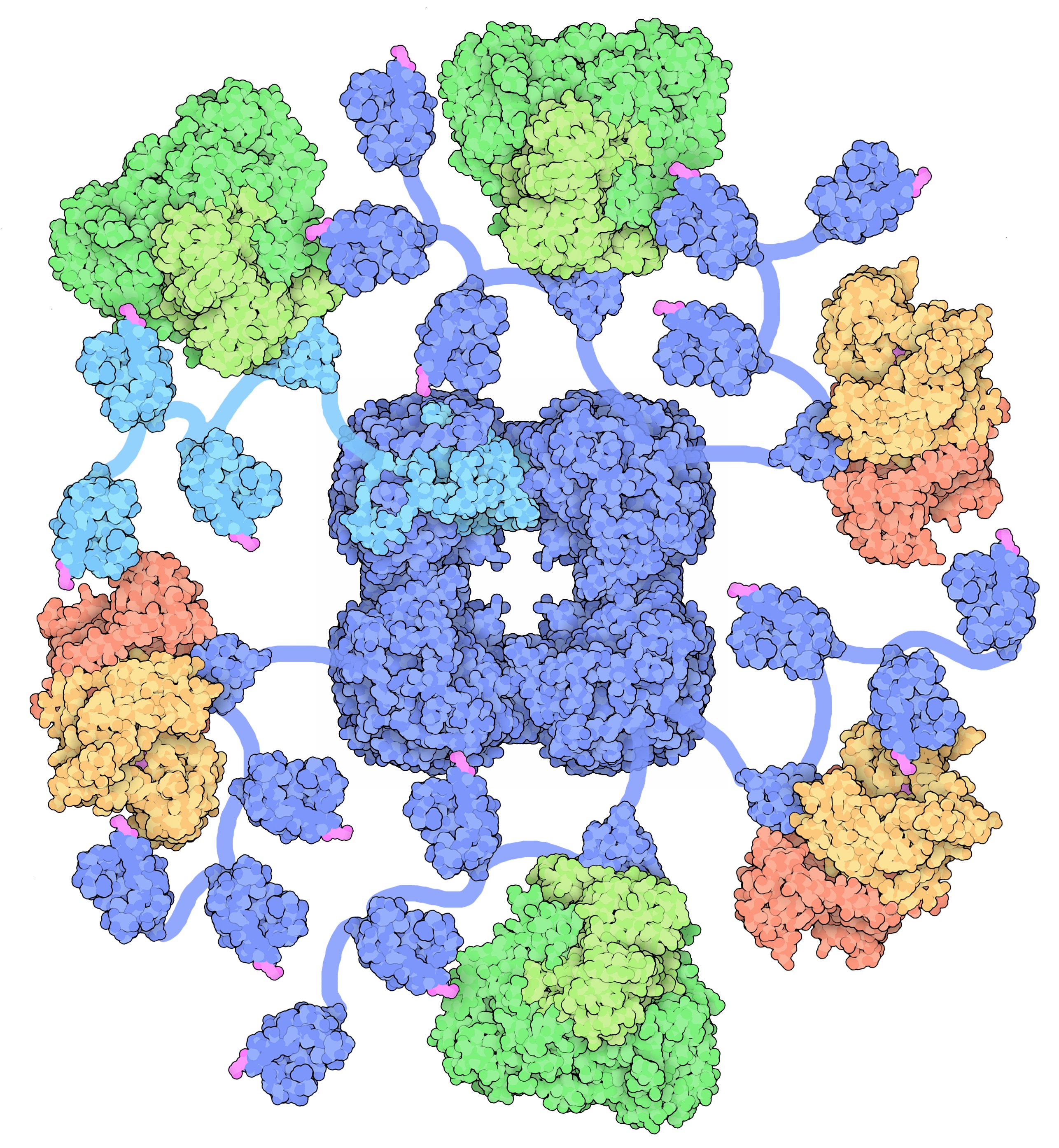
Der Pyruvat-Dehydrogenase-Komplex
David Goodsell, CC BY 3.0, via Wikimedia Commons
| Enzym | Zahl der Ketten | Co-Faktoren | Katalysierte Reaktion |
| Pyruvat- Dehydrogenase |
24 | TPP | Decarboxylierung von Pyruvat |
| Dihydrolipoyl- Transacetylase |
24 | Liponamid | Transfer der Acetylgruppe auf CoA |
| Dihydrolipoyl- Dehydrogenase |
12 | FAD / NAD+ | Regeneration des oxidierten Liponamids |
Quellen:
- Schlieper, Grundfragen der Ernährung, 21. Auflage, Hamburg 2014.
- Wikipedia, Artikel "Oxidative Decarboxylierung"
- DocCheck Flexikon, Artikel "Liponamid"
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- engl. Wikipedia, Artikel "Pyruvate dehydrogenase complex".