Struktur, Aromatizität und Eigenschaften
Struktur
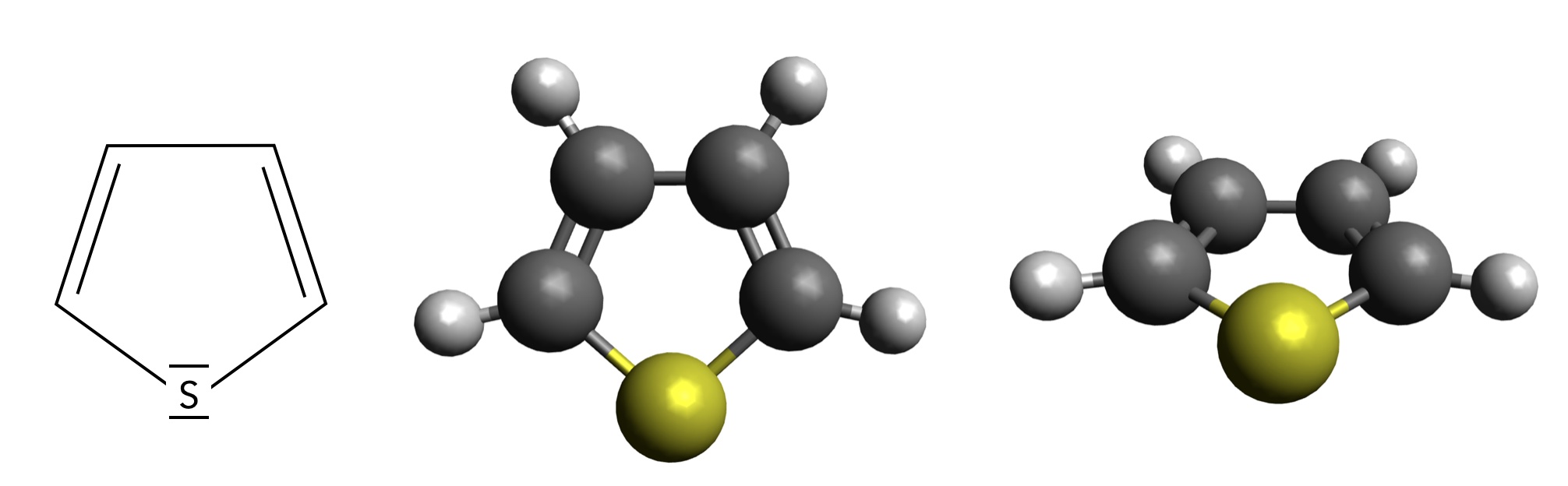
Thiophen als Strukturformel und Molekülmodell (rechts schräg von vorn betrachtet)
Autor: Ulrich Helmich 01/2024, Lizenz: CC BY-NC-SA 4.0
Das Thiophen-Molekül besteht aus einem fünfgliedrigem Ring mit vier C-Atomen und einem S-Atom als Hetero-Atom. Das Molekül ist vollkommen planar, wie das rechte Bild in Abbildung 1 zeigt.
Aromatizität
Ähnlich wie beim Furan beteiligt sich eines der beiden Elektronenpaare des Heteroatoms an dem aromatischen pi-System, das somit aus sechs Elektronen besteht und die (4n+2)-Regel von Hückel erfüllt.
Diese wichtige Regel wurde von Erich Hückel (1896-1980) um 1930 aufgestellt. Mit dieser Regel kann man beurteilen, ob eine cyclische Verbindung mit Doppelbindungen aromatisch ist oder nicht.
Eigenschaften
Pysikalische Eigenschaften
Thiophen ist eine farblose, leicht bewegliche und entflammbare, nach Benzol riechende Flüssigkeit mit einer Dichte von 1,0573 g/cm3, einem Schmelzpunkt von -38 ºC und einem Siedepunkt von 84 ºC. Thiophen ist unlöslich in Wasser, aber leicht löslich in Ethanol, Ether, Chloroform und Benzol.
Chemische Eigenschaften
Die Elektronendichte im Thiophen ist größer als im Benzol, weil sich die sechs pi-Elektronen nur auf fünf Atome verteilen und nicht auf sechs. Daher ist Thiophen reaktiver, was elektrophile Angriffe angeht, und weniger reaktiv, was nucleophile Angriffe betrifft.
In der engl. Wikipedia [5] findet man allerdings folgende etwas verstörende Aussage:
"Thiophene is considered to be aromatic, although theoretical calculations suggest that the degree of aromaticity is less than that of benzene."
In deutschen Lehrbüchern liest man meistens, dass Thiophen stärker aromatisch ist als Benzol. Und die engl. Wikipedia selbst erwähnt dann, dass die Bromierung von Thiophen viel schneller verläuft als die von Benzol:
"Thiophene brominates 107 times faster than does benzene"
Trotz seines stärkeren aromatischen Charakters kann Thiophen sich chemisch auch wie ein Dien verhalten, also elektrophile Additionen eingehen.
Biologische/medizinische Bedeutung
Eine biologische Bedeutung von Thiophen ist nicht bekannt. Einige medizinische Wirkstoffe leiten sich jedoch von Thiophen-Derivaten ab.
Weitere Einzelheiten zum Thiophen finden sich in diesem Wikipedia-Artikel.
Synthese/Herstellung
Thiophen ist ein Bestandteil des Steinkohlenteers. Da es ähnliche physikalische Eigenschaften hat wie Benzol, das ebenfalls im Steinkohlenteer vorkommt, ist es nur unter großen Schwierigkeiten von diesem abzutrennen.
In der industriellen Chemie wird Thiophen meistens aus Butan und Schwefel bei 560 ºC hergestellt:
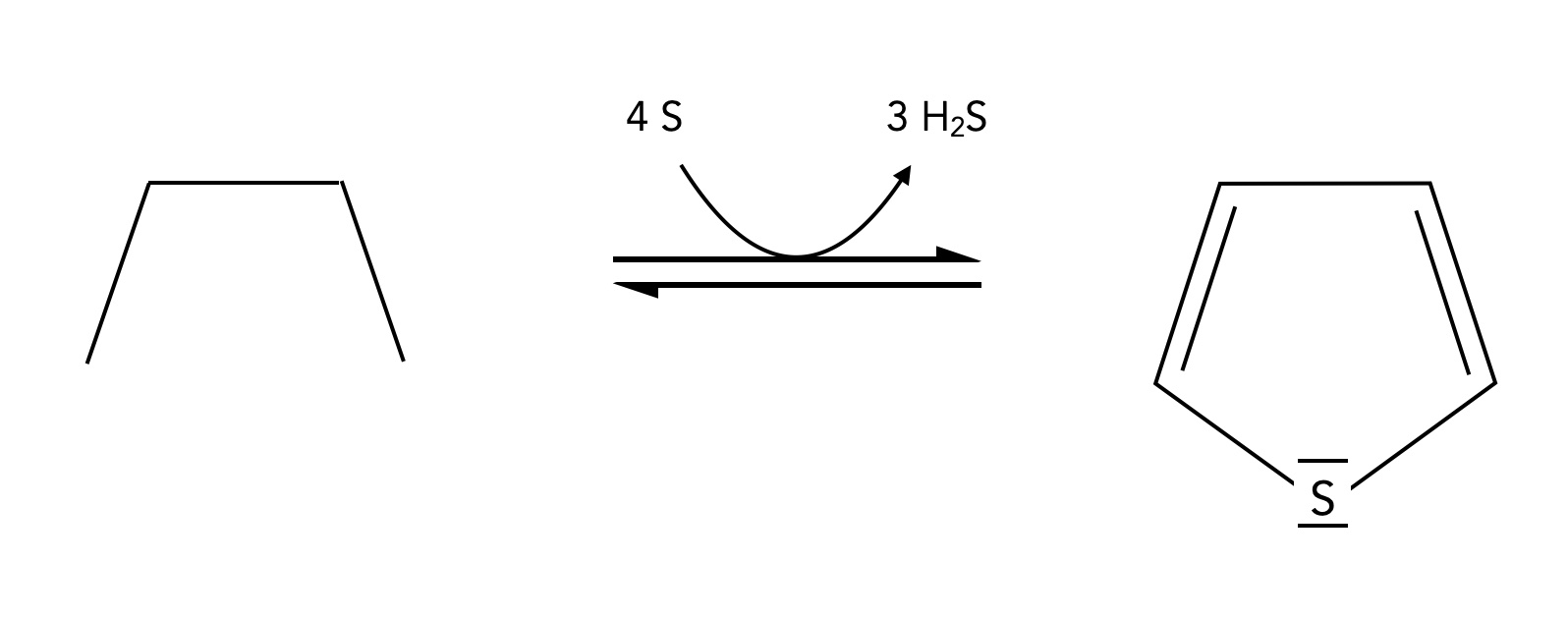
Thiophen-Synthese aus Butan und Schwefel
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Statt Butan kann auch Buten, Butadien oder 1-Butanol eingesetzt werden, und als Schwefelspender kann SO2 oder CS2 verwendet werden [1].
Im Labor kann man Thiophen herstellen, indem man Ethin C2H2 über erhitztes Eisensulfid FeS2 (Pyrit) leitet. Eine andere Methode ist es, bernsteinsaures Natrium mit Phosphortrisulfid P2S3 zu destillieren [1].
Reaktionen
Elektrophile Substitution
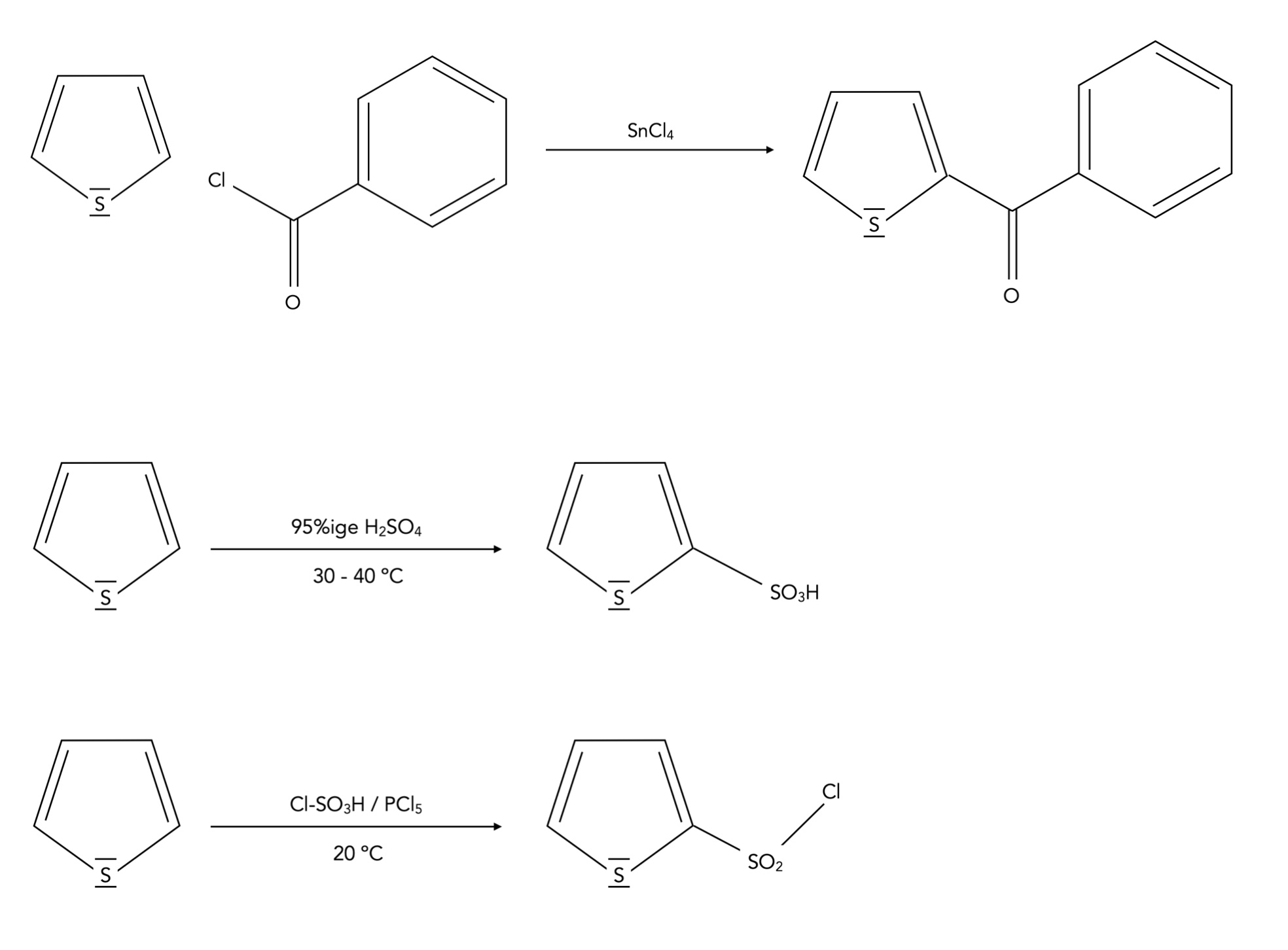
Ein paar typische Reaktionen des Thiophens
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
In diesem Bild sehen wir ein paar typische SE-Reaktionen des Thiophens. Diese drei Beispiele wurden den Quellen [3] und [4] entnommen. In [5] finden sich weitere Beispiele für Reaktionen des Thiophens.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.
- Wikipedia, Artikel "Thiophen"
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Houben-Weyl, Methoden der Organischen Chemie, Band Hetarenes I, Part 1, 4. Auflage, Stuttgart 1994.
- engl. Wikipedia, Artikel "Thiophene"